题目内容
【题目】[化学—选修3:物质结构与性质]A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 ,超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2 ②HO2在碱中不能稳定存在
③氧化产物是HO2 ④1 mol Z参加反应有1 mol电子发生转移
(5)ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。
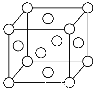
(6)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。
【答案】(1)非极性 2
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑ 原子 分子间形成氢键
(3)O>N>Al (4)1s22s22p63s23p63d104s1;③
(5)正四面体 sp3
(6)![]() (2分)
(2分)
【解析】试题分析:A元素可形成自然界硬度最大的单质,该单质为金刚石,则A为C元素;B与A同周期,核外有三个未成对电子,则B为N元素;根据X原子的第一电离能至第四电离可知,X原子的第四电离能剧增,则X表现+3价,所以X为Al元素;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质,则Y为S元素;Z的一种同位素的质量数为63、中子数为34,则质子数=63-34=29,故Z为Cu元素;
(1)AY2化学式是CS2,其结构式为S=C=S,为直线型结构,属于非极性分子,其分子中每个双键中含有1个σ键,所以CS2分子存在2个σ键;
(2)X是Al元素,铝与NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑(或2Al+2OH-+6H2O=2Al(OH)4+3H2);XB是CN,晶体与金刚石类似,属于原子晶体;B的最简单氢化物是NH3,N原子电负性大,分子间形成氢键,所以容易液化;
(3)非金属性越强,电负性越强,Al、O、N元素的电负性与非金属性一致,则三种元素电负性大到小顺序为:O>N>Al;
(4)Z为29号Cu元素,根据构造原理,其基态原子核外电子排布式为:[Ar]3d104s1或1s22s23S23p63d104s1;①O2中氧元素的化合价是0价,HO2中氧元素的化合价是-0.5价,化合价降低作氧化剂,故①正确;②HO2为超氧酸,应具有酸性,可与碱反应,故HO2在碱中不能稳定存在,故②正确;③还原产物是HO2,故③错误;④1molCu参加反应生成+1价铜离子,有1mol电子发生转移,故④正确,根据以上分析可知,不正确的为③;
(5)SO42-离子的中心原子S的价层电子对为(6+2)/2=4,孤电子对数为![]() =0,故其空间结构为正四面体,S原子杂化方式为:sp3;
=0,故其空间结构为正四面体,S原子杂化方式为:sp3;
(6)Z为Cu元素,铜原子位于顶点和面心,每个晶胞中含有铜原子的数目为:8×1/8+6×1/2=4,晶胞中含有4个铜原子,则晶胞的质量为:(64×4)/NAg,设该晶胞的边长为xcm,则该晶胞体积为:x3cm3,其密度为:ρ=![]() =9.00g/cm3,整理可得x=
=9.00g/cm3,整理可得x=![]() 。
。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
