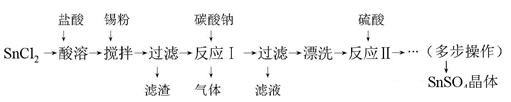
��Ŀ����
�����йص������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
| A��0.1 mol��L��1��NH4Cl��Һ�У�c(Cl��)��c(NH4+)��c(OH��)��c(H��) |
| B���������ơ���������Һ��Ϻ���Һ�����ԣ����Ϻ����Һ�У�c(Na+)��c(Cl��) |
| C����֪Ka(HF)=7.2��10-4��Ka(HCN)=6.2��10-10���������Ũ�ȵ�NaF��NaCN��Һ�У�ǰ����������С�ں��� |
| D��Ũ�Ⱦ�Ϊ0.1 mol��L��1�Ģ�(NH4)2CO3��(NH4)2SO4��(NH4)2Fe(SO4)2��Һ�У�c(NH4+)�Ĵ�С˳��Ϊ���ۣ��ڣ��� |
BC
���������A��NH4Cl��ǿ�������Σ�ˮ����Һ�����ԣ���ȷ����c(Cl��)��c(NH4+)��c(H��)��c(OH��)������B���������ơ���������Һ��Ϻ��ݵ���غ㣬c(Na+)+c(H��)=c(Cl��)+c(AC��)+c(OH��),��Һ�����ԣ�c(H��)=c(OH��),�����c(Na+)=c(Cl��)+c(AC��)�����Ի�Ϻ����Һ�У�c(Na+)��c(Cl��)����ȷ��C����Ka(HF)=7.2��10-4��Ka(HCN)=6.2��10-10����֪HCN���Ը������������Ũ�ȵ�NaF��NaCN��Һ�У�NaCN��Һ�ļ���ǿ��������������Ũ�ȴ��ݵ���غ㣬������������Ũ����ȣ���NaCN�е�������Ũ��С����ǰ�������������ں��ߣ�����D����(NH4)2CO3��笠���̼������ܷ���ˮ�⣬��ٽ���笠�Ũ����С����(NH4)2SO4����������笠����ӵ�ˮ�����Ӱ�졣��(NH4)2Fe(SO4)2�ж���������ˮ�����������笠���ˮ�⣬笠�����Ũ�����c(NH4+)�Ĵ�С˳��Ϊ���ۣ��ڣ��١���ȷ��

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
 H����B2�����ش��������⡣
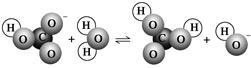
H����B2�����ش��������⡣ HCO3-��OH����ͨ��CO2��ƽ�⳯����Ӧ�����ƶ�
HCO3-��OH����ͨ��CO2��ƽ�⳯����Ӧ�����ƶ� HCO3-��OH��ƽ�⡣����˵������ȷ����(����)
HCO3-��OH��ƽ�⡣����˵������ȷ����(����)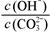 ��С
��С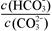 ��С
��С