题目内容
(15分)短周期元素X、Y、Z在元素周期表中的位置如右图所示,它们的质子数之和为21。

(1)氢元素与Z形成原子个数比为1∶1的化合物,其电子式为_____________。该化合物分子中存在__________(填“共价键”或“离子键”)。
(2)Y最高价氧化物的水化物与Y的氢化物恰好完全反应时,生成物的 水溶液呈酸性,其原因是_________________________________________;(用离子方程式表示)
水溶液呈酸性,其原因是_________________________________________;(用离子方程式表示)
该溶液中各种离子浓度由大到小顺序为______________________________。
(3)①恒温下,在容积为2L的刚性容器中充入2mol H2与2mol Y的单质,5分钟后反应达到平衡时,此时Y的单质为1.8mol,则产物的反应速率为
平衡时容器内压强与反应前压强比为_______ ___;
②若该反应在恒温恒压条件下进行(其它条件相同),反应达到平衡时,H2的转化率比上述条件下H2的转化率_______(填“大”、“小”或“相同”)。
(4)常温下,由X的最简单气态氢化物3.2g在氧气中完全燃烧后恢复至常温 ,放出a kJ 的热量,试写出该反应的热化学方程式:____________________________________。
,放出a kJ 的热量,试写出该反应的热化学方程式:____________________________________。

(1)氢元素与Z形成原子个数比为1∶1的化合物,其电子式为_____________。该化合物分子中存在__________(填“共价键”或“离子键”)。
(2)Y最高价氧化物的水化物与Y的氢化物恰好完全反应时,生成物的
 水溶液呈酸性,其原因是_________________________________________;(用离子方程式表示)
水溶液呈酸性,其原因是_________________________________________;(用离子方程式表示)该溶液中各种离子浓度由大到小顺序为______________________________。
(3)①恒温下,在容积为2L的刚性容器中充入2mol H2与2mol Y的单质,5分钟后反应达到平衡时,此时Y的单质为1.8mol,则产物的反应速率为
平衡时容器内压强与反应前压强比为_______ ___;
②若该反应在恒温恒压条件下进行(其它条件相同),反应达到平衡时,H2的转化率比上述条件下H2的转化率_______(填“大”、“小”或“相同”)。
(4)常温下,由X的最简单气态氢化物3.2g在氧气中完全燃烧后恢复至常温
 ,放出a kJ 的热量,试写出该反应的热化学方程式:____________________________________。
,放出a kJ 的热量,试写出该反应的热化学方程式:____________________________________。(1) (1分) 共价键 (1分)
(1分) 共价键 (1分)
(2) NH4+ + H2O NH3·H2O + H+(2分)
NH3·H2O + H+(2分)
C(NO3-)﹥C(NH4+)﹥C(H+)﹥C(OH-) (2分)
(3)0.04mol/(L.min); 9:10 大 (各2分,共6分)
(4)CH4(g) + 2O2(g) = CO2(g) + 2H2O(l)△H =" -5a" KJ/mol (3分)
=" -5a" KJ/mol (3分)
 (1分) 共价键 (1分)
(1分) 共价键 (1分)(2) NH4+ + H2O
 NH3·H2O + H+(2分)
NH3·H2O + H+(2分)C(NO3-)﹥C(NH4+)﹥C(H+)﹥C(OH-) (2分)
(3)0.04mol/(L.min); 9:10 大 (各2分,共6分)
(4)CH4(g) + 2O2(g) = CO2(g) + 2H2O(l)△H
 =" -5a" KJ/mol (3分)
=" -5a" KJ/mol (3分)略

练习册系列答案
相关题目
 技术的不断进步,研究物质的手段和途径越来越多,N
技术的不断进步,研究物质的手段和途径越来越多,N 、H3、O4、C60等已被发现。下列有关说法中,正确的是 ( )
、H3、O4、C60等已被发现。下列有关说法中,正确的是 ( ) 中含有36个电子
中含有36个电子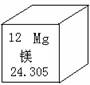

 成共价化合物
成共价化合物