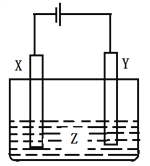
题目内容
【题目】某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+和Fe3+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:
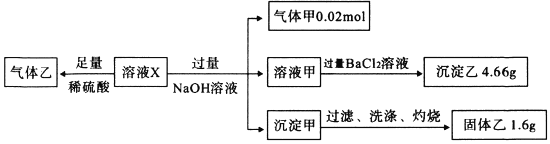
已知:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O则下列说法正确的是
A. 若含有Fe3+,则一定含有Cl-
B. SO42-、NH4+一定存在,Fe2+和Fe3+可能都存在
C. 该溶液中只存在上述离子中的NO3-、SO42-、NH4+、Fe2+四种离子
D. 气体甲能使湿润的蓝色石蕊试纸变红
【答案】C
【解析】某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+和Fe3+中的几种,且所含阴离子的物质的量相等,向溶液X中加过量的硫酸,有气体乙产生,发生的反应可能是CO32-与H+的反应,也可能是NO3-在H+条件下与Fe2+的氧化还原反应;溶液X与过量的NaOH溶液反应生成气体甲NH3为0.02mol,即溶液X中含0.02mol NH4+;所得的溶液甲中加氯化钡溶液,生成沉淀乙,则乙为BaSO4,质量为4.66g,则物质的量为0.02mol,即溶液X中含0.02mol SO42-;所得沉淀甲应为氢氧化亚铁或氢氧化铁或两者均有,经过滤、洗涤灼烧后所得的固体乙为Fe2O3,质量为1.6g,物质的量为0.01mol,故溶液X中含Fe2+或Fe3+或两者均有,且物质的量一定为0.02mol,由于Fe2+或Fe3+均能与CO32-发生双水解而不能共存,故溶液中无CO32-,则生成气体乙的反应只能是NO3-与Fe2+的氧化还原反应,故溶液中一定含Fe2+和NO3-,而所含阴离子的物质的量相等,即NO3-的物质的量也为0.02mol。故现在溶液X中已经确定存在的离子是:阴离子:0.02mol NO3-、0.02mol SO42-,共带0.06mol负电荷;阳离子:0.02mol NH4+,0.02molFe2+或Fe2+、Fe3+的混合物,所带的正电荷≥0.06mol,一定不含CO32-。根据溶液呈电中性可知,当 0.02mol全部是Fe2+时,阳离子所带正电荷为0.06mol,则氯离子一定不存在;若溶液中含Fe3+,阳离子所带正电荷大于0.06mol,则溶液中一定存在Cl-,A、由于溶液要保持电中性,故当溶液中含Fe3+时,则阳离子所带的正电荷>0.06mol,故溶液中一定含Cl-,A正确;B、SO42-、NH4+一定存在,Fe2+和Fe3+可能都存在,B正确;C、根据以上分析可知C错误;D、气体甲为氨气,能使湿润的蓝色石蕊试纸变红,D正确,答案选C。