题目内容
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
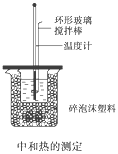
(1)烧杯间填满碎泡沫塑料的作用是_________________________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”),简述理由_________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”“无影响”)。
【答案】 减小热量散失 偏小 不相等 相等 因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关 偏小
【解析】(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60 mL 0.50 molL-1盐酸跟50 mL 0.55 molL-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60 mL 0.50 molL-1盐酸跟50 mL 0.55 molL-1NaOH溶液进行实验,测得中和热数值相等;故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关;
(4)一水合氨为弱碱,电离过程为吸热过程,所以用相同浓度和体积的氨水代替NaOH溶液反应,反应放出的热量偏小;故答案为:偏小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验现象有干扰,过多的NO、NO2又会污染环境。改进实验的设计符合绿色化学的思想。某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化。
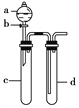
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是____________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜块,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是___________________________________________。
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________,理由是________________________________________________________________________。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该兴趣小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为_______________________,实验现象为________________________________;但此实验的不足之处是___________________________________。