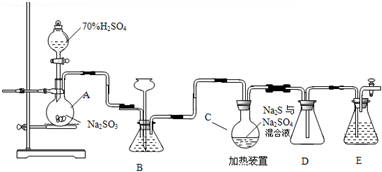
题目内容
4.乙烯和氯水作用生成2-氯乙醇.试根据2-氯乙醇的结构完成下列反应的化学方程式:(1)2-氯乙醇和浓H2SO4共热至170℃以上CH2ClCH2OH$→_{170℃}^{浓硫酸}$CHCl═CH2+H2O;
(2)2-氯乙醇和NaOH溶液共热CH2ClCH2OH$→_{△}^{NaOH}$CH2OHCH2OH+HCl;
(3)2-氯乙醇和NaOH醇溶液共热CH2ClCH2OH$→_{醇}^{NaOH}$CH3CHO+HCl;
(4)2-氯乙醇和空气混合后再通过热的铜网2CH2ClCH2OH+O2$→_{△}^{Cu}$2CH2ClCHO+2H2O;
(5)上述4种产物和银氨溶液混合后,再用水浴加热CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+2Ag↓+3NH3+H2O、CH2ClCHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH2ClCOONH4+2Ag↓+3NH3+H2O.
分析 (1)2-氯乙醇和浓硫酸共热时发生消去反应,断裂碳氧键、与羟基所连相邻碳上碳氢键;
(2)2-氯乙醇与NaOH溶液共热发生取代反应生成乙二醇和氯化氢;
(3)2-氯乙醇与NaOH乙醇溶液共热发生消去反应生成乙烯醇,烯醇不稳定生成醛;
(4)2-氯乙醇和空气混合后再通过热的铜网,2-氯乙醇被氧化成2-氯乙醛;
(5)上述4种产物和银氨溶液混合后,再用水浴加热,含有醛基的产物能被银氨试剂氧化生成羧酸,同时生成银镜.
解答 解:(1)2-氯乙醇和浓H2SO4共热至170℃时,发生消去反应,生成氯乙烯,反应方程式为:CH2ClCH2OH$→_{170℃}^{浓硫酸}$CHCl═CH2+H2O,
故答案为:CH2ClCH2OH$→_{170℃}^{浓硫酸}$CHCl═CH2+H2O;
(2)2-氯乙醇和NaOH溶液共热,氯原子被羟基取代,反应方程式为:CH2ClCH2OH$→_{△}^{NaOH}$CH2OHCH2OH+HCl,
故答案为:CH2ClCH2OH$→_{△}^{NaOH}$CH2OHCH2OH+HCl;
(3)2-氯乙醇和NaOH醇溶液共热,氯原子和相邻的碳原子发生消去反应,生成乙烯醇,反应方程式为:CH2ClCH2OH$→_{醇}^{NaOH}$CH2═CHOH+HCl,烯醇不稳定生成醛,即:CH2ClCH2OH$→_{醇}^{NaOH}$CH3CHO+HCl,
故答案为:CH2ClCH2OH$→_{醇}^{NaOH}$CH3CHO+HCl;
(4)2-氯乙醇和空气混合后再通过热的铜网,醇羟基被氧化成醛基,反应方程式为:2CH2ClCH2OH+O2$→_{△}^{Cu}$2CH2ClCHO+2H2O,
故答案为:2CH2ClCH2OH+O2$→_{△}^{Cu}$2CH2ClCHO+2H2O;
(5)上述4种产物中CH3CHO、CH2ClCHO和银氨溶液能发生银镜反应,乙醛和银氨溶液反应生成乙酸铵、水、Ag、氨气,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+2Ag↓+3NH3+H2O,2-氯乙醛和银氨溶液反应生成2-氯乙酸铵、水、Ag、氨气,反应的化学方程式为:CH2ClCHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH2ClCOONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+2Ag↓+3NH3+H2O、CH2ClCHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH2ClCOONH4+2Ag↓+3NH3+H2O.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和性质及有机反应,题目难度中等,注意相关基础知识的积累.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 150mL1mol•L-1 氯化钠溶液 | B. | 75mL 1.5mol•L-1氯化钙溶液 | ||
| C. | 150mL3mol•L-1 氯化钾溶液 | D. | 75mL 1mol•L-1 氯化铁溶液 |
| A. | 浓盐酸 | B. | 浓硫酸 | C. | 浓氨水 | D. | 苯 |
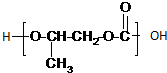
| A. |  | B. | 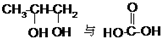 | ||
| C. | 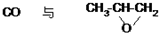 | D. |  |
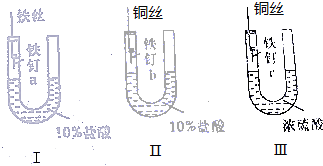 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A. | 实验结束时,装置Ⅰ左侧的液面一定会下降 | |
| B. | 实验结束时,装置Ⅰ左侧的液面一定比装置Ⅱ的低 | |
| C. | 实验结束时,铁钉b腐蚀最严重 | |
| D. | 实验结束时,铁钉c几乎没有被腐蚀 |
 用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )| A. | A极是阳极,B极为阴极 | |
| B. | A极的电极反应式为C+2H2O-4e-=CO2↑+4H+ | |
| C. | B极的电极反应式为2H++2e-=H2↑ | |
| D. | 电解一段时间后,煤浆液的pH增大 |