题目内容
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是( )
2NH3(g) △H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是( )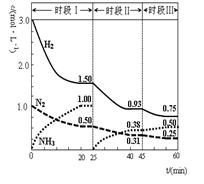
| A.前20分钟反应内放出的热量为46.2kJ |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
A
解析试题分析:A. N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。表示每摩尔的该反应发生放出热量92.4 kJ。从图可看出C(N2)的浓度改变 1.5mol/L,但由于没有容器的容积,所以不知道反应的N2的物质的量的多少,也就无法计算反应热的多少。错误。B.有图可看出:在第25分钟NH3的浓度为O,其余的物质浓度没变,所以改变的条件就是将NH3从反应体系中分离出去。正确。C.反应N2(g)+3H2(g)
2NH3(g) △H=-92.4 kJ·mol-1。表示每摩尔的该反应发生放出热量92.4 kJ。从图可看出C(N2)的浓度改变 1.5mol/L,但由于没有容器的容积,所以不知道反应的N2的物质的量的多少,也就无法计算反应热的多少。错误。B.有图可看出:在第25分钟NH3的浓度为O,其余的物质浓度没变,所以改变的条件就是将NH3从反应体系中分离出去。正确。C.反应N2(g)+3H2(g) 2NH3(g)的正反应是放热反应。升高温度化学平衡向吸热反应方向移动即向逆反应方向移动;降低温度,平衡向放热反应方向移动及向正反应方向移动。达到新的平衡时N2(g)和3H2(g)的浓度减小,NH3(g)的浓度增大。与图像符合。正确。D.平衡常数只与温度有关,与物质的投入量无关。因此时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变。正确。
2NH3(g)的正反应是放热反应。升高温度化学平衡向吸热反应方向移动即向逆反应方向移动;降低温度,平衡向放热反应方向移动及向正反应方向移动。达到新的平衡时N2(g)和3H2(g)的浓度减小,NH3(g)的浓度增大。与图像符合。正确。D.平衡常数只与温度有关,与物质的投入量无关。因此时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变。正确。
考点:考查关于可逆反应的热量、转化率平衡常数及影响因素的知识。

下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是
| A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了 |
| B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 |
| C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大 |
| D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka ·Kh |
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
可逆反应2SO2 + O2 2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )
2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )
| A.SO3和O2 中 | B.SO3和SO2 中 |
| C.SO3, SO2和O2 中 | D.SO2和O2 中 |
 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是 C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是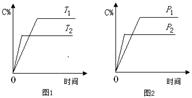
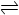

 pC(g)+qD(g) △H<0。下列结论中错误的是
pC(g)+qD(g) △H<0。下列结论中错误的是