题目内容
【题目】(1)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

①“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_______________。
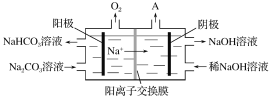
②“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为___________,阴极产生的物质A的化学式为________。
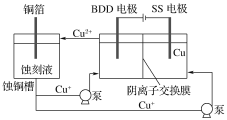
(2)与常规方法不同,有研究者用HCl—CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生,回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO·),请写出BDD电极上的电极反应________,进一步反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式__________。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
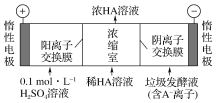
①阳极的电极反应式为____________。
②简述浓缩室中得到浓乳酸的原理:__________________
【答案】石墨电极被阳极上产生的O2氧化 4CO32-+2H2O-4e-=4HCO3-+O2↑ H2 OH--e-=HO· Cu++HO·+H+=Cu2++H2O 4OH--4e-=2H2O+O2↑ 阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;A-通过阴离子交换膜从阴极进入浓缩室,H++A-=HA,乳酸浓度增大
【解析】
(1)以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3、铝硅酸钠,碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气,以此分析解答。
(2)由图示可知阳极生成HO,在阳极上发生H++Cu++OH=Cu2++H2O,Cl-通过阴离子交换膜移入阳极区可生成CuCl2蚀刻液;
(3)①电解池中阳极上氢氧根离子失电子生成氧气;②根据电解池中离子的移动方向分析解答。
(1)①“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极上生成氧气,石墨电极被阳极上产生的O2氧化,易消耗,故答案为:石墨电极被阳极上产生的O2氧化;
②“电解Ⅱ”是电解Na2CO3溶液,由图可知,阳极溶液中的阴离子即水中的OH-放电生成O2,2H2O-4e-=O2↑+4H+,H+与CO32-结合生成HCO3-,由图阳极区Na2CO3生成NaHCO3),总电极反应为4CO32-+2H2O-4e-═4HCO3-+O2↑,阴极上氢离子得到电子生成氢气,故答案为:4CO32-+2H2O-4e-═4HCO3-+O2↑;H2;
(2)由图示可知阳极生成HO,电极反应式为OH--e-=HO (或H2O-e-=HO+H+),在阳极上发生H++Cu++OH=Cu2++H2O,然后H++Cu++OH=Cu2++H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区可生成CuCl2蚀刻液,故答案为:OH--e-=HO (或H2O-e-=HO+H+);H++Cu++OH=Cu2++H2O
(3)①阳极上是阴离子(氢氧根离子)发生失电子的氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
②在电解池的阳极上是OH-放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A-通过阴离子交换膜从阴极进入浓缩室,这样:H++A-═HA,乳酸浓度增大,故答案为:阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大。