题目内容
【题目】某研究性学习小组拟对SO2和亚硫酸的性质进行探究。请回答下列问题:
Ⅰ.探究SO2和Fe(NO3)3溶液的反应
该小组用图所示装置达成实验目的。已知:1.0mol/L Fe(NO3)3溶液的pH=1。
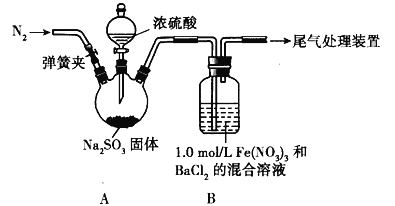
(1)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_____。
(2)装置B中产生了白色沉淀,说明SO2具有_____性。
(3)分析B中产生白色沉淀的原因:
①观点1:SO2与Fe3+反应;观点2:酸性条件下,SO2与NO3﹣反应;观点3:_____。
②按观点1,装置B 中反应的离子方程式为_____,为证明该观点,应进一步确认生成的新物质,实验操作及现象是_____。
③按观点2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。此时应选择的最佳溶液是_____(填序号)。
a.0.1mol/L 稀硝酸
b.1.5mol/L Fe(NO3)2
c.3.0mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液
d.6.0mol/L NaNO3溶液和0.2mol/L盐酸等体积混合的溶液
Ⅱ.探究H2SO3的酸性强于HClO。
该小组用图所示装置达成实验目的。
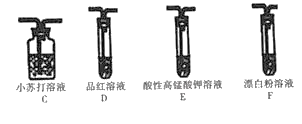
(4)装置的连接顺序为:纯净SO2→_____(选填字母),F中反应的离子方程式为_____。
(5)可证明H2SO3的酸性强于HClO的实验现象是_____。
【答案】打开弹簧夹,向体系中通入一段时间的N2,关闭弹簧夹 还原 性。 SO2与Fe3+、NO3﹣(H+)都反应 SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+ 取少量B中溶液于一支洁净的试管中,加入几滴铁氰化钾溶液,如果产生蓝色沉淀,就说明有亚铁离子生成,观点1正确 d CEDF Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO D中品红溶液不褪色,F中出现白色沉淀 。
【解析】
I.(1)因为空气中氧气也具有氧化性,对实验造成干扰,为防止空气干扰,用氮气将空气排出,所以为排尽空气,滴加浓硫酸之前应进行的操作是打开弹簧夹,向体系中通入一段时间的N2,关闭弹簧夹;
(2)SO2和BaCl2溶液不反应,装置B中有白色沉淀生成,说明有BaSO4生成,该反应中S元素化合价由+4价变为+6价,则二氧化硫体现还原性;
(3)①观点3:SO2与Fe3+及酸性条件下与NO3﹣也反应;
②按观点1,SO2与Fe3+反应生成BaSO4和Fe2+,离子方程式为SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,要检验Fe2+可以用铁氰化钾溶液检验,其操作及现象为取少量B中溶液于一支洁净的试管中,加入几滴铁氰化钾溶液,如果产生蓝色沉淀,就说明有亚铁离子生成,观点1正确;
③按观点2,只需将装置B中的Fe(NO3)3溶液替换为c(H+)=0.1mol/L、c(NO3﹣)=3.0mol/L的溶液即可,
a、0.1mol/L 稀硝酸中c(NO3﹣)不符合,故a错误;
b、1.5mol/L Fe(NO3)2中c(H+)不符合,故b错误;
c、3.0mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液中c(NO3﹣)不符合,故错c误;
d、6.0mol/L NaNO3溶液和0.2mol/L盐酸等体积混合的溶液中c(H+)、c(NO3﹣)都符合,故d正确;
Ⅱ.(4)探究H2SO3的酸性强于HClO,可以用强酸制取弱酸的方法检验,因为亚硫酸具有还原性、HClO具有强氧化性,二者发生氧化还原反应,所以应该先将亚硫酸转化为没有还原性酸,再用该酸与次氯酸盐制取次氯酸即可,C装置制取二氧化碳、D装置检验二氧化硫、E装置吸收二氧化硫、F装置制取HClO,所以装置顺序为CEDF,F中离子方程式为Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO;
(5)D中品红不褪色,就说明气体中不含二氧化硫,只有二氧化碳,二氧化碳再和漂白粉溶液反应生成白色沉淀即可证明,所以可证明H2SO3的酸性强于HClO的实验现象是D中品红溶液不褪色,F中出现白色沉淀。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。请回答下列问题:
(1)已知:H2的燃烧热△H为-285.8kJ/mol。
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ/mol
H2O(g)=H2O(1) △H=-44 kJ/mol
则H2和NO2反应生成两种无污染的气体的热化学反应方程式为______________________。
(2)一定温度下,向2L恒容密闭容器中充入0.40molN2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①0~40s内,v(NO2)=___________。
②升高温度时,气体颜色加深,则上述反应是___________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=___________。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)___________(填“>”=”或”<”)0.60mol/L
(3)已知2NO(g)+O2(g)![]() 2NO2(g) △H的反应历程分两步:
2NO2(g) △H的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”“<”或“=”),其判断理由是____________________;2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正/span>、k2逆的关系式为______________________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正/span>、k2逆的关系式为______________________。
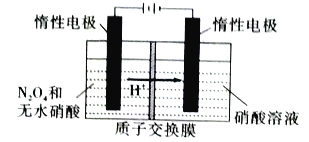
(4)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O的装置。写出阳极区生成N2O5的电极反应式(注意阳极区为无水环境,HNO3亦无法电离): _________________________________。
【题目】I.(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
① HA + HB- (少量)=A-+ H2B,② H2B(少量) + C-=HB-+ HC,③ HA(少量) + C-=A-+ HC 。
则三种酸对应的电离平衡常数分别为(请在下面填空):________
HA | H2B | HC | ||
Ka | Ka1 | Ka2 | Ka3 | Ka4 |
数值 | ||||
(2)常温下0.1 mol/L CH3COOH溶液加水稀释过程,下列表达式数据一定变小是________。
A.c(H+) B.n(H+) C. c(CH3COO-)/ c(H+) D.c(CH3COOH)/c(H+)
II.工业废水中常含有一定量的Cr2O72- 和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。

(1)转化过程中存在平衡2CrO42- + 2H+![]() Cr2O72- + H2O能说明反应到达平衡状态的是____。
Cr2O72- + H2O能说明反应到达平衡状态的是____。
A.CrO42-和Cr2O72-的浓度相同 B.ν正(Cr2O72-)=2 ν逆(CrO42-)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1 L转化后所得溶液中含铬元素质量为28.6 g,CrO42- 有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。
① 转化后所得溶液中c(Cr2O72-)=_________________。
② 已知:常温下该反应的平衡常数K=1014,上述溶液转化后H+的物质的量浓度为_________。


