题目内容
标准状况下,乙烷与某烃的混合气体1.344 L与足量氧气混合后,点燃爆炸,所得气体通过240 mL 0.500 mol·L-1 NaOH溶液中,使逸出气体中不含CO2。把吸收CO2后的溶液在减压低温条件下蒸干得到固体质量为7.60 g(不含结晶水)。(1)通过计算确定原混合气体的成分。
(2)计算原混合气体中各组分的体积。
(1)C2H6与CH4的混合气体
(2)V(C2H6)=0.448 L,V(CH4)=0.896 L
解析:(1)n(NaOH)=0.24 L×0.500 mol·L-1=0.12 mol。
设所得7.60 g固体中,含有Na2CO3和NaHCO3的物质的量分别为x、y,根据题意有:
2x+y=0.12 mol(钠元素守恒)
106 g·mol-1x+84 g·mol-1y=7.60 g(所得固体质量)
由此求出:x=0.04 mol,y=0.04 mol。
则碳元素的物质的量为
0.04 mol+0.04 mol=0.08 mol
n混烃=![]() =0.06 mol,混合烃中碳原子的平均值为=
=0.06 mol,混合烃中碳原子的平均值为=![]() 。
。
其中一种组分是乙烷(分子式中碳原子数为2,大于![]() ),根据平均值原理可知,另一种组分的分子式中的碳原子数必小于
),根据平均值原理可知,另一种组分的分子式中的碳原子数必小于![]() ,一定是甲烷,即原混合烃由CH4和C2H6组成。
,一定是甲烷,即原混合烃由CH4和C2H6组成。
(2)设原混合烃中,CH4为a mol,C2H6为b mol,则有:
a+b=0.06(混合烃的总物质的量)
a+2b=0.08(混合烃中的碳元素)
求得a=0.04,b=0.02。
所以原混合烃中各组分的体积分别为:
V(CH4)=0.896 L,V(C2H6)=0.448 L。

练习册系列答案
相关题目
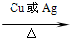 2CH3CHO+2H2O
2CH3CHO+2H2O
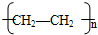 ,
, CH3COOC2H5+H2O,
CH3COOC2H5+H2O,