题目内容
在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是______(填序号)
A.SO42- B.NO3-C.Cl- D.CO32-
(2)为检测废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂是______;铝元素发生变化的离子方程式是______;
(3)为了回收废液中的金属银,某同学设计了如图所示方案:
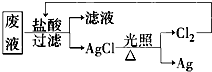
若依该方案获得108g Ag,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下H2的体积是______.
(1)该废液中可能大量存在的一种阴离子是______(填序号)
A.SO42- B.NO3-C.Cl- D.CO32-
(2)为检测废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂是______;铝元素发生变化的离子方程式是______;
(3)为了回收废液中的金属银,某同学设计了如图所示方案:

若依该方案获得108g Ag,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下H2的体积是______.
(1)因硫酸银不溶液水,氯化银不溶于水,金属离子与碳酸根离子生成不溶于水的碳酸盐,所有的硝酸盐都溶于水,即硝酸根离子与金属离子均不反应,故答案为:B;
(2)只有氢氧化铝与碱反应,利用碱将金属阳离子分离,则试剂选NaOH溶液,发生的离子反应为Al3++4OH-═AlO2-+2H2O,
故答案为:NaOH溶液;Al3++4OH-═AlO2-+2H2O;
(3)n(Ag)=
=1mol,由2Ag~Cl2~H2可知,理论上应提供标准状况下H2的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2L.
(2)只有氢氧化铝与碱反应,利用碱将金属阳离子分离,则试剂选NaOH溶液,发生的离子反应为Al3++4OH-═AlO2-+2H2O,
故答案为:NaOH溶液;Al3++4OH-═AlO2-+2H2O;
(3)n(Ag)=
| 108g |
| 108g/mol |

练习册系列答案
相关题目