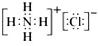题目内容
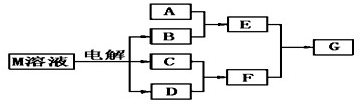
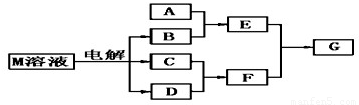
(10分)已知物质M由属于同一周期的X.Y两种短周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6.M与其他物质的转化关系如下(部分产物已略去):
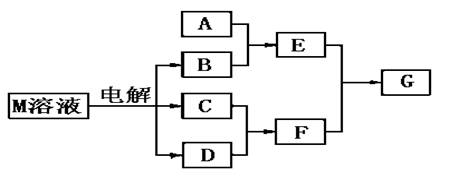
(1)已知元素Z与Y是最外层电子数相同的短周期元素,那么Z与Y分别与氢形成的氢化物中沸点较高的是 (填化学式);
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则E溶液与F溶液反应的离子方程式是: ;
(3)若A是与X、Y同周期元素的一种常见金属单质,且A与B溶液能够反应,则其化学方程式是: ;
(4)若A是一种常见的化肥,相对分子质量为79,且E与F生成G时有白烟产生,则A的化学式 ;
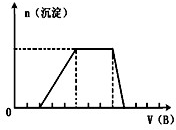
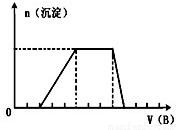
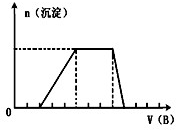
(5)若A是一种溶液,只可能含有H+.NH4+、Mg2+、Fe3+、Al3+、CO32—、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积变化如图所示,由此可知,该溶液中肯定含有的离子符号(微粒次序按摩尔质量从小到大)及物质的量浓度之比为
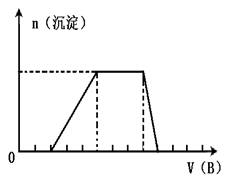 .
.
【答案】
(1)HF
(2)SiO32-+2H+= H2SiO3↓;
(3)2NaOH+2H2O+2Al=2NaAlO2+ 3H2↑;
(4)NH4HCO3 ;
(5)(H+、NH4+、Al3+、SO42- )2:3:1:4。
【解析】略

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
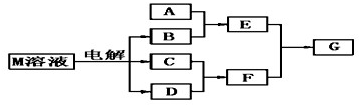
 (4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则A的化学式
(4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则A的化学式