题目内容
(2011?安庆三模)下列关于溶液中离子浓度的叙述一定正确的是( )
分析:A.盐酸易挥发,加热浓度变小;
B.由于酸的强弱不确定,混合后溶液不一定呈中性;
C.从物料守恒的角度分析;
D.根据盐对应的酸的酸辛强弱比较水解程度.
B.由于酸的强弱不确定,混合后溶液不一定呈中性;
C.从物料守恒的角度分析;
D.根据盐对应的酸的酸辛强弱比较水解程度.
解答:解:A.加热NaCl溶液,浓度变大,盐酸易挥发,加热浓度变小,故A错误;
B.由于酸的强弱不确定,混合后溶液不一定呈中性,故B错误;
C.将等体积等物质的量浓度的CH3COOH与CH3COOK混合,由物料守恒可知2(K+)=c(CH3COO-)+c(CH3COOH),溶液中存在,故C正确;
D.已知酸性:CH3COOH>C6H5OH>HCO3-,酸性越弱,对应的盐类水解程度越大,则pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液:c(CH3COO-)>c(C6H5O-)>c(CO32-),故D错误.
故选C.
B.由于酸的强弱不确定,混合后溶液不一定呈中性,故B错误;
C.将等体积等物质的量浓度的CH3COOH与CH3COOK混合,由物料守恒可知2(K+)=c(CH3COO-)+c(CH3COOH),溶液中存在,故C正确;
D.已知酸性:CH3COOH>C6H5OH>HCO3-,酸性越弱,对应的盐类水解程度越大,则pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液:c(CH3COO-)>c(C6H5O-)>c(CO32-),故D错误.
故选C.
点评:本题考查离子浓度大小比较,题目难度中等,本题注意把握盐类水解程度的大小比较.

练习册系列答案
相关题目
 (2011?安庆三模)竖炉冶铁工艺流程如图所示,燃烧室中主要反应为:
(2011?安庆三模)竖炉冶铁工艺流程如图所示,燃烧室中主要反应为: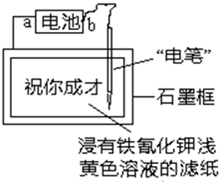 (2011?安庆三模)已知:含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀.现用如图装置在浸有铁氰化钾浅黄色溶液的滤纸上写出特征蓝色的字“祝你成才”.据此判断下列说法正确的是( )
(2011?安庆三模)已知:含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀.现用如图装置在浸有铁氰化钾浅黄色溶液的滤纸上写出特征蓝色的字“祝你成才”.据此判断下列说法正确的是( )