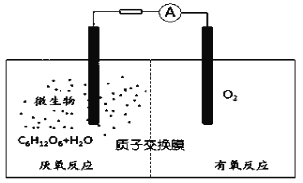
题目内容
【题目】[化学——选修3:物质结构与性质]N、P、As都是同主族的元素。
(1)As基态原子的电子排布式为 。和砷位于同一周期,且未成对电子数也相同的元素还有 种。
(2)元素周期表中,与P紧邻的4种元素中电负性最强的是 (填元素符号),Si、P、S三元素第一电离能由大到小的顺序为 。
(3)NH3、PH3、AsH3三者的空间构型相同,都是 ,它们的沸点由高到低的顺序为 (填化学式)
(4)白磷是由P4分子形成的分子晶体,每个P4分子是正四面体结构(如图)。
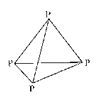
P的杂化方式为 。白磷易溶于CS2,难溶于水,原因是 。
(5)采用GaxIn(1-x)As(镓铟砷)等材料,可提高太阳能电池的效率。GaxIn(1-x)As立方体形晶胞中每1个顶点和面心都有1个原子,晶胞内部有4个原子,则该晶胞中含有 个砷原子。
【答案】(1)1s22s24p63s23p63d104s24p3(2分) 2 (2分)
(2)N(1分), P>S>Si, (2分)
(3)三角锥形(1分)NH3>AsH3>PH3 (1分)
(4)sp3(1分);白磷分子为非极性分子,而水为极性分子,(根据相似相溶原理),所以白磷不溶解于水中(2分) (5)4(2分)
【解析】
试题分析:(1)As的质子数是33,其基态原子的电子排布式为1s22s24p63s23p63d104s24p3。和砷位于同一周期,且未成对电子数也相同的元素,它们的外围电子排布式为:3d34s2、3d74s2,分别为钒、钴两种;
(2)在元素周期表中,同周期中从左向右,元素的非金属性增强,电负性增强,同主族元素从上向下,元素的非金属性减弱,电负性减弱,在元素周期表中,与 P紧邻的4种元素中电负性最大的是N;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,Si、P、S元素处于同一周期且原子序数逐渐增大,P处于第VA族,所以第一电离能P>S>Si;
(3)NH3、PH3、AsH3三者的空间构型相同,都是三角锥形结构;NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物分子间作用力大,沸点高,故沸点:NH3>AsH3>PH3;
(4)P4分子为正四面体构型,P4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,P原子采取sp3杂化;相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于 CS2,难溶于水;
(5)GaxIn(1-x)As立方体形晶胞中每一个顶点和面心都有一个原子,晶胞内部有4个原子,晶胞含有总数为4+8×1/8+6×1/2=8,由化学式可知晶胞中As数目占原子总数的1/2,即晶胞中As原子数目为8×1/2=4。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案