题目内容
下列说法正确的是
A.用氯酸钾固体和浓盐酸制氯气的反应方程式: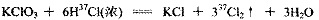 |
| B.向含有大量Ca2+、Cl—、Al3+的溶液中通入适量SO2,有沉淀生成 |
| C.用少量酸性KMnO4溶液可以检测FeCl3浓溶液中是否含有Fe2+ |
| D.常温下Ksp[Cu(OH)2]=2.2×10-20,则常温下2.2mol/L CuCl2溶液的pH不大于4 |
D
试题分析:A项,该反应是一个归中反应,6mol HCl有5molCl被氧化成2.5molCl2,还有0.5molCl2的氯原子来自KClO3,同时6mol HCl中还有1mol氯原子化合价没有变,到KCl中去了,所以6mol氯-37,5mol在氯气中,1mol在氯化钾中,错误。B项,SO2通入上述溶液中,首先生成亚硫酸,亚硫酸不会与钙离子反应生成沉淀,错误。C项,FeCl3浓溶液呈棕黄色,并且颜色很浓,即使里面有Fe2+,并加入少量酸性KMnO4溶液,反应的现象并不明显,错误。D项,首先计算CuCl2溶液Cu2+沉淀最小的pH,
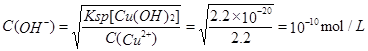 则pH=4,因此常温下2.2mol/L CuCl2溶液的pH≤4。
则pH=4,因此常温下2.2mol/L CuCl2溶液的pH≤4。
练习册系列答案
相关题目