题目内容
现将足量的浓硝酸与铜反应,生成4.48L的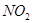 气体(标况下),求:
气体(标况下),求:
(1)参加反应的铜的质量;
(2)被还原的硝酸的物质的量;
(3)将得到的溶液稀释到500ml,求溶液中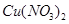 的物质的量浓度。
的物质的量浓度。
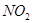 气体(标况下),求:
气体(标况下),求:(1)参加反应的铜的质量;
(2)被还原的硝酸的物质的量;
(3)将得到的溶液稀释到500ml,求溶液中
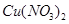 的物质的量浓度。
的物质的量浓度。(1)6.4g (2)0.2mol (3)0.2mol/L
试题分析:(1)生成的NO2是4.48L÷22.4L/mol=0.2mol
反应中转移电子的物质的量是0.2mol
则根据电子的得失守恒可知
参加反应的铜的质量
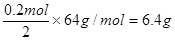
(2)根据氮原子守恒可知
被还原的硝酸的物质的量就是NO2的物质的量,即0.2mol。
(3)溶液中硝酸铜的物质的量是0.1mol
所以硝酸铜的物质的量浓度=0.1mol÷0.5L=0.2mol/L
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。有利于培养学生的逻辑推理能力和规范的答题能力。该题的关键是在明确反应原理的基础上,灵活运用各种守恒法,即质量守恒定律、原子守恒、电荷守恒以及电子的得失守恒等。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目

