题目内容
已知SO2和H2O2在溶液中发生如下反应:H2O2+SO2===H2SO4。取0.6g某含硫、铁的物质,将它在氧气中灼烧,使硫全部转化为SO2,用稀的过氧化氢溶液吸收。吸收液恰好与20.0mL1mol/LNaOH溶液反应。求:
(1)此物质中硫的质量分数;
(2)此物质中铁与硫的原子个数之比(取整数比)。
【答案】
(1)53.3% (2)1:2
【解析】
试题分析:(1)氢氧化钠的物质的量是0.020L×1mol/L=0.02mol
则根据方程式H2SO4+2NaOH=Na2SO4+2H2O可知硫酸的物质的量是0.01mol
因此根据S原子守恒可知
此物质中硫的质量分数是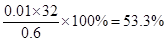
(2)根据(1)可知,硫元素的质量是0.32g
所以铁元素的质量是0.6g-0.32g=0.28g
则铁原子的物质的量是0.28g÷56g/mol=0.005mol
所以此物质中铁与硫的原子个数之比是1︰2
考点:考查S及其化合物的有关计算
点评:该题是基础性试题的考查,难度不大,该题的胶体思路是根据守恒法,本题有利于培养学生的逻辑思维能力,以及规范答题能力。

练习册系列答案
相关题目