题目内容
(18分)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
(1)在这些元素中,最活泼的非金属元素是 化学性质最不活泼元素原子的原子结构示意图为 ;
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是 ,
呈两性的氢氧化物是 ;
(3)最强碱的电子式为:_____________ ①的气态氢化物的电子式:_____________________
④和⑦所形成化合物的电子式:________________________。
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是 ,
呈两性的氢氧化物是 ;
(3)最强碱的电子式为:_____________ ①的气态氢化物的电子式:_____________________
④和⑦所形成化合物的电子式:________________________。
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
(10分) (1) F (2) HClO4 Al(OH)3
(3)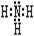

(4)Cl2 2NaBr+Cl2=2NaCl+Br2(2分)
(3)
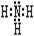

(4)Cl2 2NaBr+Cl2=2NaCl+Br2(2分)
(1)元素的非金属性同一周期:从左到右依次依次增强,同一主族从上倒下依次减弱,所以在这些元素中,最活泼的非金属元素是②,第二周期第七主族为F,化学性质最不活泼的是0族的稀有气体元素,表中⑧为Ar,Ar的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性根据元素周期律同一周期从左到有依次增强,
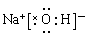 同一主族从上到下依次减弱,F无最高价氧化物,所以最强的是⑦,氯元素,最高价氧化物对应的水化物为高氯酸; HClO4 高中阶段学习的呈两性的氢氧化物为Al(OH)3
同一主族从上到下依次减弱,F无最高价氧化物,所以最强的是⑦,氯元素,最高价氧化物对应的水化物为高氯酸; HClO4 高中阶段学习的呈两性的氢氧化物为Al(OH)3
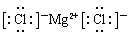 (3)表中元素形成的最强的碱为氢氧化钠其电子式为 ; ①为N,其氢化物为氨气,电子式为
(3)表中元素形成的最强的碱为氢氧化钠其电子式为 ; ①为N,其氢化物为氨气,电子式为 ;④和⑦所形成化合物是
;④和⑦所形成化合物是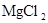 电子式为:
电子式为:
(4) ⑦的单质是 ,⑩的单质是
,⑩的单质是 ,处于同一主族,非金属性逐渐降低,活泼性
,处于同一主族,非金属性逐渐降低,活泼性 大于
大于 ,
, 可以从溴的化合物的溶液中置换出溴单质,化学方程式为2NaBr+Cl2=2NaCl+Br2。
可以从溴的化合物的溶液中置换出溴单质,化学方程式为2NaBr+Cl2=2NaCl+Br2。
(2)元素的最高价氧化物对应的水化物中酸性根据元素周期律同一周期从左到有依次增强,
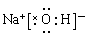 同一主族从上到下依次减弱,F无最高价氧化物,所以最强的是⑦,氯元素,最高价氧化物对应的水化物为高氯酸; HClO4 高中阶段学习的呈两性的氢氧化物为Al(OH)3
同一主族从上到下依次减弱,F无最高价氧化物,所以最强的是⑦,氯元素,最高价氧化物对应的水化物为高氯酸; HClO4 高中阶段学习的呈两性的氢氧化物为Al(OH)3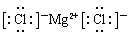 (3)表中元素形成的最强的碱为氢氧化钠其电子式为 ; ①为N,其氢化物为氨气,电子式为
(3)表中元素形成的最强的碱为氢氧化钠其电子式为 ; ①为N,其氢化物为氨气,电子式为 ;④和⑦所形成化合物是
;④和⑦所形成化合物是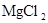 电子式为:
电子式为:(4) ⑦的单质是
 ,⑩的单质是
,⑩的单质是 ,处于同一主族,非金属性逐渐降低,活泼性
,处于同一主族,非金属性逐渐降低,活泼性 大于
大于 ,
, 可以从溴的化合物的溶液中置换出溴单质,化学方程式为2NaBr+Cl2=2NaCl+Br2。
可以从溴的化合物的溶液中置换出溴单质,化学方程式为2NaBr+Cl2=2NaCl+Br2。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
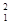 H原子的中子数和质子数
H原子的中子数和质子数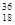 Ar原子中的质量数和中子数
Ar原子中的质量数和中子数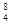 Be2+离子中的电子数和质子数
Be2+离子中的电子数和质子数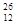 Mg2+离子中的中子数和电子数
Mg2+离子中的中子数和电子数
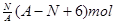
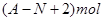
 、
、