题目内容
分析化学反应:3 Cu2S+16HNO3═6Cu(NO3)2+4NO+3S+8H2O,下列说法不正确的是( )
| A、只有硫元素被氧化 |
| B、NO是还原产物 |
| C、还原剂与氧化剂的物质的量之比是3:16 |
| D、0.3mol Cu(NO3)2生成时转移电子0.6mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为0价,N元素化合价由+5价变为+2价,所以Cu2S是还原剂、部分硝酸是氧化剂,据此分析解答.
解答:
解:该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为0价,N元素化合价由+5价变为+2价,
A.根据元素化合价知,S、Cu元素被氧化,故A错误;
B.硝酸是氧化剂,则NO是还原产物,故B正确;
C.该反应中有
的硝酸作氧化剂,所以还原剂和氧化剂的物质的量之比为3:4,故C错误;
D.0.3mol Cu(NO3)2生成时转移电子的物质的量=
×12=0.6mol,故D正确;
故选AC.
A.根据元素化合价知,S、Cu元素被氧化,故A错误;
B.硝酸是氧化剂,则NO是还原产物,故B正确;
C.该反应中有
| 1 |
| 4 |
D.0.3mol Cu(NO3)2生成时转移电子的物质的量=
| 0.3mol |
| 6 |
故选AC.
点评:本题考查了氧化还原反应,明确元素化合价变化是解本题关键,注意被氧化的元素种类,知道硝酸的作用,题目难度不大.

练习册系列答案
相关题目
可逆反应 CO(g)+H2O(g)?CO2(g)+H2(g),温度为749K时,K=1;CO的起始浓度为2mol?L-1,H2O的起始浓度为6mol?L-1时,在密闭容器达到平衡,CO的转化率为( )
| A、80% | B、75% |
| C、50% | D、25% |
对于一个在一定条件下达到平衡、全部是气态物质的可逆反应,下列条件的改变,可能只改变反应速率而不影响平衡发生移动的是( )
| A、升高温度 |
| B、固定容积的容器中增加反应物浓度 |
| C、缩小容器的体积 |
| D、移走平衡体系中的生成物 |
下列各种物质中属于同素异形体的是( )
| A、金刚石和磁铁矿石 |
| B、Na2O2和Na2O |
| C、S8和S12 |
| D、I2和I- |
下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
A、 酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
B、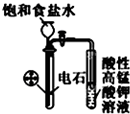 实验室制乙炔并验证其性质 |
C、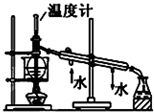 实验室中分馏石油 |
D、 分离碘酒中的碘和酒精 |
分类是化学学习与研究的常用方法,下列分类正确的是( )
| A、Na2O、MgO、Al2O3均属于碱性氧化物 |
| B、根据电解质在水溶液中电离的程度,将电解质分为强电解 质和弱电解质 |
| C、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D、石灰石、生石灰、熟石灰均属于碱 |
 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
 .有机物X的键线式为:
.有机物X的键线式为: