ћвƒњƒЏ»Ё
ѕ¬√ж «ƒ≥÷–—Іїѓ—І–Ћ»§–°„й‘Џ25°ж ±≤вґ®“їѕµЅ–≈®ґ»∞±ЋЃµƒpHЋщґ‘”¶µƒc£®OH-£©£Ї
[“«∆ч”л ‘ЉЅ]Ћбґ»Љ∆°Ґ50mLЉо љµќґ®є№°Ґ100mL…’±≠°Ґ0.10mol?L-1 ∞±ЋЃ
[ µ—й эЊЁ]£®≤ї±Ўћо±нЄс£©
| …’±≠Ї≈ | V∞±ЋЃ £®mL£© | VЋЃ£®mL£© | c £®NH3?H2O£© £®mol?L-1£© | c£®OH-£© | Kb | ¶Ѕ |
| 1 | 50.00 | 0.00 | 1.34°Ѕ10-3 | |||
| 2 | 25.00 | 25.00 | 9.48°Ѕ10-4 | |||
| 3 | 5.00 | 45.00 | 4.24°Ѕ10-4 |
£®1£©25°ж ±£ђ∞±ЋЃµƒµзјл≥£ э£ЇKb°÷______£ђЌ®єэЉ∆ЋгЋщµ√µƒ эЊЁЇЌЉтљаµƒќƒ„÷Ћµ√чµзјл≥£ э°Ґµзјлґ»”л»хµзљв÷ µƒ≥х Љ≈®ґ»µƒєЎѕµ______
£®2£©”√0.10mol?L-1—ќЋбЈ÷±рµќґ®20.00mL0.10mol?L-1µƒNaOH»№“ЇЇЌ20.00mL0.10mol?L-1∞±ЋЃЋщµ√µƒµќґ®«ъѕя»зѕ¬£Ї
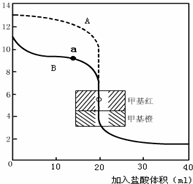
«л÷Є≥ц—ќЋбµќґ®∞±ЋЃµƒ«ъѕяќ™______£®ћоAїтB£©£ђ«л–і≥ц«ъѕяaµгЋщґ‘”¶µƒ»№“Ї÷–Єчјл„”≈®ґ»”…іуµљ–°µƒ≈≈Ѕ–Ћ≥–т______£Ѓ
£®3£©“Ї∞±„чќ™“ї÷÷«±‘Џµƒ«еља∆ы≥µ»ЉЅѕ“—‘љјі‘љ±ї—–Њњ»Ћ‘±÷Ў ”£ЃЋь‘Џ∞≤»Ђ–‘°ҐЉџЄсµ»Јљ√жљѕїѓ ѓ»ЉЅѕЇЌ«в»ЉЅѕ”–„≈љѕіуµƒ”≈ ∆£Ѓ∞±‘Џ»Љ…’ ‘—йїъ÷–ѕаєЎµƒЈі”¶”–£Ї
4NH3£®g£©+3O2£®g£©=2N2£®g£©+6H2O£®l£©°чH1Ґў
4NH3£®g£©+5O2£®g£©=4NO£®g£©+6H2O£®l£©°чH2ҐЏ
4NH3£®g£©+6NO£®g£©=5N2£®g£©+6H2O£®l£©°чH3Ґџ
«л–і≥ц…ѕ ц»эЄцЈі”¶÷–°чH1°Ґ°чH2°Ґ°чH3»э’я÷ЃЉдєЎѕµµƒ±ніп љ£ђ°чH1=______£Ѓ
£®4£©Allis-Chalmers÷∆‘мєЂЋЊЈҐѕ÷њ…“‘”√∞±„чќ™»ЉЅѕµз≥Ўµƒ»ЉЅѕ£Ѓ∆д„№Јі”¶ љќ™4NH3+3O2=2N2+6H2O£ђ’эЉЂ…ѕµƒµзЉЂЈі”¶ љќ™O2+
2H2O+4e-=4OH-£ђ‘тЄЇЉЂ…ѕµƒµзЉЂЈі”¶ љќ™______£Ѓ
| 1.34°Ѕ10-3°Ѕ1.34°Ѕ10-3 |
| 0.1 |
µЏґю„й µ—й÷–µƒKb=
| 9.48°Ѕ10-4°Ѕ9.48°Ѕ10-4 |
| 0.05 |
µЏ»э„й µ—й÷–µƒKb=
| 4.24°Ѕ10-4°Ѕ4.24°Ѕ10-4 |
| 0.01 |
»эЄц µ—й÷–µƒµзјлґ»Ј÷±рќ™
| 1.34°Ѕ10-3 |
| 0.1 |
| 9.48°Ѕ10-4 |
| 0.05 |
| 4.24°Ѕ10-4 |
| 0.01 |
£®2£©”…0.10mol?L-1µƒNaOH»№“ЇµƒpH=13£ђ”…ЌЉѕуњ…÷™£ђAќ™—ќЋбµќґ®«в—хїѓƒ∆µƒ«ъѕя£ђ‘тBќ™—ќЋбµќґ®∞±ЋЃµƒ«ъѕя£ђ‘Џ«ъѕяaµгpH£Њ7њ…÷™£ђ»№“Їѕ‘Љо–‘£ђc£®OH-£©£Њc£®H+£©£ђ‘ўЄщЊЁµзЇ… ЎЇгњ…÷™£ђc£®Cl-£©+c£®OH-£©=c£®NH4+£©+c£®H+£©£ђ‘тc£®NH4+£©£Њc£®Cl-£©£ђµзјл≤ъ…ъ«в—хЄщјл„”£ђ‘тc£®NH4+£©£Њc£®Cl-£©£Њc£®OH-£©£Њc£®H+£©£ђ
є ір∞Єќ™£ЇB£їc£®NH4+£©£Њc£®Cl-£©£Њc£®OH-£©£Њc£®H+£©£ї
£®3£©”…Јі”¶4NH3£®g£©+3O2£®g£©=2N2£®g£©+6H2O£®l£©°чH1 Ґў
4NH3£®g£©+5O2£®g£©=4NO£®g£©+6H2O£®l£©°чH2 ҐЏ
4NH3£®g£©+6NO£®g£©=5N2£®g£©+6H2O£®l£©°чH3Ґџ
‘тЈі”¶
| ҐЏ°Ѕ3+Ґџ°Ѕ2 |
| 5 |
| 3°чH2+2°чH3 |
| 5 |
| 3°чH2+2°чH3 |
| 5 |
£®4£©”…„№Јі”¶4NH3+3O2=2N2+6H2O£ђ’эЉЂЈі”¶ќ™O2+2H2O+4e-=4OH-£ђ”…µз„” ЎЇг£ђ‘т„№Јі”¶≥э“‘2Љх»•’эЉЂЈі”¶Љіњ…µ√ЄЇЉЂЈі”¶ љ£ђЄЇЉЂЈі”¶ љќ™2NH3+6OH--6e-=N2+6H2O£ђ
є ір∞Єќ™£Ї2NH3+6OH--6e-=N2+6H2O£Ѓ

 ћмћмѕт…ѕ“ї±ЊЇ√ЊнѕµЅ–ір∞Є
ћмћмѕт…ѕ“ї±ЊЇ√ЊнѕµЅ–ір∞Є –°—І…ъ10Ј÷÷””¶”√ћвѕµЅ–ір∞Є
–°—І…ъ10Ј÷÷””¶”√ћвѕµЅ–ір∞Є∞±”–„≈єгЈЇµƒ”√ЌЊ£ђ»зњ…”√”ЏїѓЈ °ҐѕхЋб°ҐЇѕ≥…ѕЋќђµ»є§“µ…ъ≤ъ°£∞±µƒЋЃ»№“Ї÷–іж‘Џµзјл∆љЇв£ђ≥£”√µзјл≥£ эKbЇЌµзјлґ»¶Ѕјіґ®Ѕњ±н Њ∆дµзјл≥ћґ»°£KbЇЌ¶Ѕ≥£”√µƒ≤вґ®ЈљЈ®£Ї‘Џ“їґ®ќ¬ґ» ±”√Ћбґ»Љ∆≤вґ®“їѕµЅ–“—÷™≈®ґ»∞±ЋЃµƒpH£ђњ…µ√Єч≈®ґ»∞±ЋЃґ‘”¶µƒc(OH-)£ђ»їЇуЌ®єэїїЋг«уµ√Єчґ‘”¶µƒ¶Ѕ÷µЇЌKb÷µ°£ѕ¬√ж «ƒ≥÷–—Іїѓ—І–Ћ»§–°„й‘Џ25°ж ±≤вґ®“їѕµЅ–≈®ґ»∞±ЋЃµƒpHЋщґ‘”¶µƒc(OH-)£Ї
°Њ“«∆ч”л ‘ЉЅ°њЋбґ»Љ∆°Ґ50 mLЉо љµќґ®є№°Ґ100mL…’±≠°Ґ 0.10 mol°§L-1 ∞±ЋЃ
°Њ µ—й эЊЁ°њ(≤ї±Ўћо±нЄс)
| …’±≠Ї≈ | V∞±ЋЃ (mL) | VЋЃ(mL) | c (NH3°§H2O) £®mol°§L-1£© | c(OH-) | Kb | ¶Ѕ |
| 1 | 50.00 | 0.00 |
| 1.34°Ѕ10-3 |
|
|
| 2 | 25.00 | 25.00 |
| 9.48°Ѕ10-4 |
|
|
| 3 | 5.00 | 45.00 |
| 4.24°Ѕ10-4 |
|
|
«лЄщЊЁ“‘…ѕ–≈ѕҐїЎірѕ¬ цќ ћв£Ї
£®1£©25°ж ±£ђ∞±ЋЃµƒµзјл≥£ э£ЇKb![]() °ш £ђЌ®єэЉ∆ЋгЋщµ√µƒ эЊЁЇЌЉтљаµƒќƒ„÷Ћµ√чµзјл≥£ э°Ґµзјлґ»”л»хµзљв÷ µƒ≥х Љ≈®ґ»µƒєЎѕµ °ш °£
°ш £ђЌ®єэЉ∆ЋгЋщµ√µƒ эЊЁЇЌЉтљаµƒќƒ„÷Ћµ√чµзјл≥£ э°Ґµзјлґ»”л»хµзљв÷ µƒ≥х Љ≈®ґ»µƒєЎѕµ °ш °£
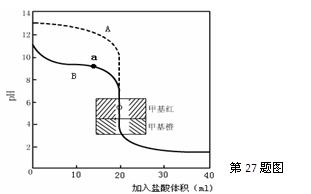
£®2£©”√0.10mol°§L°™1—ќЋбЈ÷±рµќґ®20.00mL0.10mol°§L°™1µƒNaOH»№“ЇЇЌ20.00mL0.10mol°§L°™1
∞±ЋЃЋщµ√µƒµќґ®«ъѕя»зѕ¬£Ї
«л÷Є≥ц—ќЋбµќґ®∞±ЋЃµƒ«ъѕяќ™ °ш £®ћоAїтB£©£ђ«л–і≥ц«ъѕяaµгЋщґ‘”¶µƒ»№“Ї÷–Єчјл„”≈®ґ»”…іуµљ–°µƒ≈≈Ѕ–Ћ≥–т °ш °£
£®3£©“Ї∞±„чќ™“ї÷÷«±‘Џµƒ«еља∆ы≥µ»ЉЅѕ“—‘љјі‘љ±ї—–Њњ»Ћ‘±÷Ў ”°£Ћь‘Џ∞≤»Ђ–‘°ҐЉџЄсµ»Јљ√жљѕїѓ ѓ»ЉЅѕЇЌ«в»ЉЅѕ”–„≈љѕіуµƒ”≈ ∆°£∞±‘Џ»Љ…’ ‘—йїъ÷–ѕаєЎµƒЈі”¶”–£Ї
4NH3£®g£©+3O2£®g£©= 2N2£®g£©+6H2O£®l£© °чH1 Ґў
4NH3£®g£©+5O2£®g£©= 4NO£®g£©+6H2O£®l£© °чH2 ҐЏ
4NH3£®g£©+6NO£®g£©= 5N2£®g£©+6H2O£®l£© °чH3 Ґџ
«л–і≥ц…ѕ ц»эЄцЈі”¶÷–°чH1°Ґ°чH2°Ґ°чH3»э’я÷ЃЉдєЎѕµµƒ±ніп љ£ђ°чH1= °ш °£
£®4£©Allis-Chalmers÷∆‘мєЂЋЊЈҐѕ÷њ…“‘”√∞±„чќ™»ЉЅѕµз≥Ўµƒ»ЉЅѕ°£∆д„№Јі”¶ љќ™4NH3+3O2=2N2+6H2O£ђ’эЉЂ…ѕµƒµзЉЂЈі”¶ љќ™O2+2H2O+4e°™=4OH°™£ђ‘тЄЇЉЂ…ѕµƒµзЉЂЈі”¶ љќ™ °ш °£
∞±”–„≈єгЈЇµƒ”√ЌЊ£ђ»зњ…”√”ЏїѓЈ °ҐѕхЋб°ҐЇѕ≥…ѕЋќђµ»є§“µ…ъ≤ъ°£∞±µƒЋЃ»№“Ї÷–іж‘Џµзјл∆љЇв£ђ≥£”√µзјл≥£ эKbЇЌµзјлґ»¶Ѕјіґ®Ѕњ±н Њ∆дµзјл≥ћґ»°£KbЇЌ¶Ѕ≥£”√µƒ≤вґ®ЈљЈ®£Ї‘Џ“їґ®ќ¬ґ» ±”√Ћбґ»Љ∆≤вґ®“їѕµЅ–“—÷™≈®ґ»∞±ЋЃµƒpH£ђњ…µ√Єч≈®ґ»∞±ЋЃґ‘”¶µƒc(OH-)£ђ»їЇуЌ®єэїїЋг«уµ√Єчґ‘”¶µƒ¶Ѕ÷µЇЌKb÷µ°£ѕ¬√ж «ƒ≥÷–—Іїѓ—І–Ћ»§–°„й‘Џ25°ж ±≤вґ®“їѕµЅ–≈®ґ»∞±ЋЃµƒpHЋщґ‘”¶µƒc(OH-)£Ї
°Њ“«∆ч”л ‘ЉЅ°њЋбґ»Љ∆°Ґ50 mLЉо љµќґ®є№°Ґ100mL…’±≠°Ґ 0.10 mol°§L-1∞±ЋЃ
°Њ µ—й эЊЁ°њ(≤ї±Ўћо±нЄс)
| …’±≠Ї≈ | V∞±ЋЃ (mL) | VЋЃ(mL) | c (NH3°§H2O)£®mol°§L-1£© | c(OH-) | Kb | ¶Ѕ |
| 1 | 50.00 | 0.00 | | 1.34°Ѕ10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48°Ѕ10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24°Ѕ10-4 | | |
£®1£©25°ж ±£ђ∞±ЋЃµƒµзјл≥£ э£ЇKb
 °ш £ђЌ®єэЉ∆ЋгЋщµ√µƒ эЊЁЇЌЉтљаµƒќƒ„÷Ћµ√чµзјл≥£ э°Ґµзјлґ»”л»хµзљв÷ µƒ≥х Љ≈®ґ»µƒєЎѕµ °ш °£
°ш £ђЌ®єэЉ∆ЋгЋщµ√µƒ эЊЁЇЌЉтљаµƒќƒ„÷Ћµ√чµзјл≥£ э°Ґµзјлґ»”л»хµзљв÷ µƒ≥х Љ≈®ґ»µƒєЎѕµ °ш °££®2£©”√0.10mol°§L°™1—ќЋбЈ÷±рµќґ®20.00mL0.10mol°§L°™1µƒNaOH»№“ЇЇЌ20.00mL0.10mol°§L°™1
∞±ЋЃЋщµ√µƒµќґ®«ъѕя»зѕ¬£Ї
«л÷Є≥ц—ќЋбµќґ®∞±ЋЃµƒ«ъѕяќ™ °ш £®ћоAїтB£©£ђ«л–і≥ц«ъѕяaµгЋщґ‘”¶µƒ»№“Ї÷–Єчјл„”≈®ґ»”…іуµљ–°µƒ≈≈Ѕ–Ћ≥–т °ш °£
£®3£©“Ї∞±„чќ™“ї÷÷«±‘Џµƒ«еља∆ы≥µ»ЉЅѕ“—‘љјі‘љ±ї—–Њњ»Ћ‘±÷Ў ”°£Ћь‘Џ∞≤»Ђ–‘°ҐЉџЄсµ»Јљ√жљѕїѓ ѓ»ЉЅѕЇЌ«в»ЉЅѕ”–„≈љѕіуµƒ”≈ ∆°£∞±‘Џ»Љ…’ ‘—йїъ÷–ѕаєЎµƒЈі”¶”–£Ї
4NH3£®g£©+3O2£®g£©= 2N2£®g£©+6H2O£®l£© °чH1 Ґў
4NH3£®g£©+5O2£®g£©= 4NO£®g£©+6H2O£®l£© °чH2 ҐЏ
4NH3£®g£©+6NO£®g£©= 5N2£®g£©+6H2O£®l£© °чH3 Ґџ
«л–і≥ц…ѕ ц»эЄцЈі”¶÷–°чH1°Ґ°чH2°Ґ°чH3»э’я÷ЃЉдєЎѕµµƒ±ніп љ£ђ°чH1= °ш °£
£®4£©Allis-Chalmers÷∆‘мєЂЋЊЈҐѕ÷њ…“‘”√∞±„чќ™»ЉЅѕµз≥Ўµƒ»ЉЅѕ°£∆д„№Јі”¶ љќ™4NH3+3O2= 2N2+6H2O£ђ’эЉЂ…ѕµƒµзЉЂЈі”¶ љќ™O2+2H2O+4e°™=4OH°™£ђ‘тЄЇЉЂ…ѕµƒµзЉЂЈі”¶ љќ™ °ш °£
∞±”–„≈єгЈЇµƒ”√ЌЊ£ђ»зњ…”√”ЏїѓЈ °ҐѕхЋб°ҐЇѕ≥…ѕЋќђµ»є§“µ…ъ≤ъ°£∞±µƒЋЃ»№“Ї÷–іж‘Џµзјл∆љЇв£ђ≥£”√µзјл≥£ эKbЇЌµзјлґ»¶Ѕјіґ®Ѕњ±н Њ∆дµзјл≥ћґ»°£KbЇЌ¶Ѕ≥£”√µƒ≤вґ®ЈљЈ®£Ї‘Џ“їґ®ќ¬ґ» ±”√Ћбґ»Љ∆≤вґ®“їѕµЅ–“—÷™≈®ґ»∞±ЋЃµƒpH£ђњ…µ√Єч≈®ґ»∞±ЋЃґ‘”¶µƒc(OH-)£ђ»їЇуЌ®єэїїЋг«уµ√Єчґ‘”¶µƒ¶Ѕ÷µЇЌKb÷µ°£ѕ¬√ж «ƒ≥÷–—Іїѓ—І–Ћ»§–°„й‘Џ25°ж ±≤вґ®“їѕµЅ–≈®ґ»∞±ЋЃµƒpHЋщґ‘”¶µƒc(OH-)£Ї
°Њ“«∆ч”л ‘ЉЅ°њЋбґ»Љ∆°Ґ50 mLЉо љµќґ®є№°Ґ100mL…’±≠°Ґ 0.10 mol°§L-1 ∞±ЋЃ
°Њ µ—й эЊЁ°њ(≤ї±Ўћо±нЄс)
|
…’±≠Ї≈ |
V∞±ЋЃ (mL) |
VЋЃ(mL) |
c (NH3°§H2O) £®mol°§L-1£© |
c(OH-) |
Kb |
¶Ѕ |
|
1 |
50.00 |
0.00 |
|
1.34°Ѕ10-3 |
|
|
|
2 |
25.00 |
25.00 |
|
9.48°Ѕ10-4 |
|
|
|
3 |
5.00 |
45.00 |
|
4.24°Ѕ10-4 |
|
|
«лЄщЊЁ“‘…ѕ–≈ѕҐїЎірѕ¬ цќ ћв£Ї
£®1£©25°ж ±£ђ∞±ЋЃµƒµзјл≥£ э£ЇKb °ш £ђЌ®єэЉ∆ЋгЋщµ√µƒ эЊЁЇЌЉтљаµƒќƒ„÷Ћµ√чµзјл≥£ э°Ґµзјлґ»”л»хµзљв÷ µƒ≥х Љ≈®ґ»µƒєЎѕµ
°ш °£
°ш £ђЌ®єэЉ∆ЋгЋщµ√µƒ эЊЁЇЌЉтљаµƒќƒ„÷Ћµ√чµзјл≥£ э°Ґµзјлґ»”л»хµзљв÷ µƒ≥х Љ≈®ґ»µƒєЎѕµ
°ш °£
£®2£©”√0.10mol°§L°™1—ќЋбЈ÷±рµќґ®20.00mL0.10mol°§L°™1µƒNaOH»№“ЇЇЌ20.00mL0.10mol°§L°™1
∞±ЋЃЋщµ√µƒµќґ®«ъѕя»зѕ¬£Ї
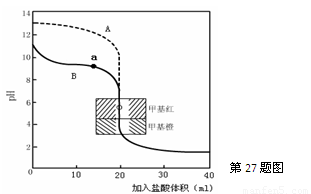
«л÷Є≥ц—ќЋбµќґ®∞±ЋЃµƒ«ъѕяќ™ °ш £®ћоAїтB£©£ђ«л–і≥ц«ъѕяaµгЋщґ‘”¶µƒ»№“Ї÷–Єчјл„”≈®ґ»”…іуµљ–°µƒ≈≈Ѕ–Ћ≥–т °ш °£
£®3£©“Ї∞±„чќ™“ї÷÷«±‘Џµƒ«еља∆ы≥µ»ЉЅѕ“—‘љјі‘љ±ї—–Њњ»Ћ‘±÷Ў ”°£Ћь‘Џ∞≤»Ђ–‘°ҐЉџЄсµ»Јљ√жљѕїѓ ѓ»ЉЅѕЇЌ«в»ЉЅѕ”–„≈љѕіуµƒ”≈ ∆°£∞±‘Џ»Љ…’ ‘—йїъ÷–ѕаєЎµƒЈі”¶”–£Ї
4NH3£®g£©+3O2£®g£©= 2N2£®g£©+6H2O£®l£© °чH1 Ґў
4NH3£®g£©+5O2£®g£©= 4NO£®g£©+6H2O£®l£© °чH2 ҐЏ
4NH3£®g£©+6NO£®g£©= 5N2£®g£©+6H2O£®l£© °чH3 Ґџ
«л–і≥ц…ѕ ц»эЄцЈі”¶÷–°чH1°Ґ°чH2°Ґ°чH3»э’я÷ЃЉдєЎѕµµƒ±ніп љ£ђ°чH1= °ш °£
£®4£©Allis-Chalmers÷∆‘мєЂЋЊЈҐѕ÷њ…“‘”√∞±„чќ™»ЉЅѕµз≥Ўµƒ»ЉЅѕ°£∆д„№Јі”¶ љќ™4NH3+3O2= 2N2+6H2O£ђ’эЉЂ…ѕµƒµзЉЂЈі”¶ љќ™O2+2H2O+4e°™=4OH°™£ђ‘тЄЇЉЂ…ѕµƒµзЉЂЈі”¶ љќ™ °ш °£