题目内容
5.在一密闭容器中有HCHO、H2、和O2混合气体共10g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重4g,则原混合气体中O2的质量分数是( )| A. | 40% | B. | 33.3% | C. | 60% | D. | 36% |
分析 HCHO燃烧生成二氧化碳与水,氢气燃烧生成水,反应方程式为HCHO+O2$\stackrel{点燃}{→}$CO2+H2O,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,二氧化碳、水与过氧化钠反应2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体中HCHO、H2的质量和,据此可知原混合物中氧气的质量,从而可计算出混合物中氧气的质量分数.
解答 解:HCHO燃烧生成二氧化碳与水,氢气燃烧生成水,反应方程式为:HCHO+O2HCHO+O2$\stackrel{点燃}{→}$CO2+H2O、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
二氧化碳、水与过氧化钠反应为:2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2,
通过方程式可以看出,固体质量的增加量就是原混合气体中HCHO、H2的质量和,
Na2O2增重4g,所以HCHO、H2的质量和为4g,
所以混合气体中氧气的质量为:10g-4g=6g,
所以氧气的质量分数为:$\frac{6g}{10g/mol}$×100%=60%,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,判断过氧化钠固体质量增加实质为氢气与一氧化碳的质量事实解题关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
15.下列四种试剂均需密封保存,密封保存的原因,其中一种与其它三种不同. 这种试剂是( )
| A. | 浓盐酸 | B. | 浓硫酸 | C. | 浓氨水 | D. | 苯 |
13.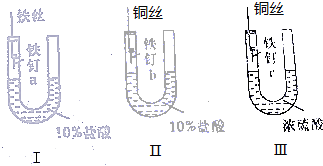 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A. | 实验结束时,装置Ⅰ左侧的液面一定会下降 | |
| B. | 实验结束时,装置Ⅰ左侧的液面一定比装置Ⅱ的低 | |
| C. | 实验结束时,铁钉b腐蚀最严重 | |
| D. | 实验结束时,铁钉c几乎没有被腐蚀 |
5.总压强为30Mpa时,氮气﹑氢气混合气体(体积比为1:3)通入合成塔,反应达平衡时,压强降为25Mpa则平衡时混合气体中氨气的体积分数为( )
| A. | 25% | B. | 20% | C. | 35% | D. | 30% |
12.在容积为2L的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示.下列说法正确的是( )
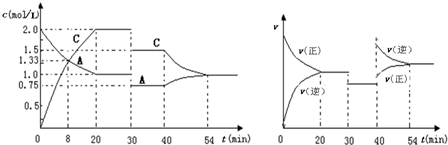

| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
9. 用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
 用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )| A. | A极是阳极,B极为阴极 | |
| B. | A极的电极反应式为C+2H2O-4e-=CO2↑+4H+ | |
| C. | B极的电极反应式为2H++2e-=H2↑ | |
| D. | 电解一段时间后,煤浆液的pH增大 |
10.下列化学用语表述不正确的是( )
| A. | HCl的电子式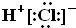 | B. | CH4的球棍模型: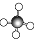 | ||
| C. | S2-的结构示意图为 | D. | 乙烯的结构简式: |