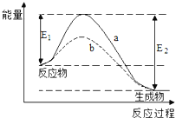
题目内容
【题目】大气污染越来越成为人们关注的问题,烟气中的 NOx 必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2 (g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1;N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;CH4 可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=_____。
(2)C2H4 也可用于烟气脱硝。为研究温度、催化剂中 Cu2+负载量对 NO 去除率的影响,控制其它条件一定,实验结果如图 所示。为达到最高的 NO 去除率,应选择的反应温度和 Cu2+负 载量分别是_____。

(3)臭氧也可用于烟气脱硝。一种臭氧发生装置原理如图 所示。阳极(惰性电极)的电极反应 式为_____。
(4) NO 直接催化分解(生成 N2 与 O2)也是一种脱硝途径。在不同条件下, NO 的分解产物不同。在高压下,NO 在 40 ℃下分解生成两种化合物, 体系中各组分物质的量随时间变化曲线如图 所示。写出 Y 和 Z 的化 学式: _____。

【答案】-1250.3kJ·mol1 350℃左右、3% 3H2O-6e=O3↑+6H+ N2O、NO2
【解析】
(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJmol-1,②N2(g)+O2(g)═2NO(g) △H=+180kJmol-1,根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),据此计算;
(2)根据图象找出NO去除率最高时对应的温度和催化剂中Cu2+负载量;
(3)酸性条件下,水在阳极失电子生成臭氧;
(4)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图象可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物。
(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJmol-1,②N2(g)+O2(g)═2NO(g);△H=+180kJmol-1,根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJmol-1-2×(+180kJmol-1)=-1250.3 kJmol-1,故答案为:-1250.3 kJmol-1;
(2)由图1可知在350℃左右,催化剂中Cu2+负载量为3%时,NO去除率最高,故答案为:350℃左右、3%;
(3)酸性条件下,水在阳极失电子生成臭氧,生成1mol臭氧转移6mol电子,则电极方程式为:3H2O-6e-═O3↑+6H+,故答案为:3H2O-6e-═O3↑+6H+;
(4)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2,故答案为:N2O、NO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知:乙二酸俗称草酸(结构简式为HOOCCOOH,可简写为H2C2O4)。25℃时,草酸钙的Ksp=4.0×108,碳酸钙的Ksp=2.5×109。回答下列问题:
(1)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×104mol/L的草酸钾溶液20mL,能否产生沉淀________(填“能”或“不能”)。
(2)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
I.实验前首先用浓度为0.1000molL1酸性KMnO4标准溶液滴定未知浓度的草酸。
①滴定过程中操作滴定管的图示正确的是________(填编号)。

②判断滴定终点的方法是:________。
③若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度__________(填“偏高”或“偏低”或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000molL1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温度 (℃) | 催化剂用量 (g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 | |
体积(mL) | 浓度(molL1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
b.实验1和3探究反应物浓度对该反应速率的影响;c.实验1和4探究催化剂对该反应速率的影响。 | |||||
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
④写出表中a对应的实验目的________;
⑤该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1次 | 第2次 | 第3次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案______。