题目内容
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。请回答下列问题:
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式 。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为 ,SO2—4的立体构型是 ,其中S原子的杂化轨道类型是 。
(3)N、O、F三种元素的电负性由大到小的顺序为 ,Cu2O的熔点高于Cu2S,请解释原因: 。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为 。
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为 [列式并计算,结果用科学记数法表示,保留两位小数,己知Ar(Cu)=63.6]。
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式 。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为 ,SO2—4的立体构型是 ,其中S原子的杂化轨道类型是 。
(3)N、O、F三种元素的电负性由大到小的顺序为 ,Cu2O的熔点高于Cu2S,请解释原因: 。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为 。
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为 [列式并计算,结果用科学记数法表示,保留两位小数,己知Ar(Cu)=63.6]。
(1)5s25p2(2分)
(2)离子键、共价键、配位健(2分) 正四面体(1分) sp3杂化(1分)
(3)F>O>N(2分) Cu2O、Cu2S都是离子晶体,O2-半径比S2-半径小,阴阳离子的核间距小,晶格能大,熔点高(2分)
(4)Cu+H2O2+4NH3=[Cu(NH3)4](OH)2(2分)
(5)NA=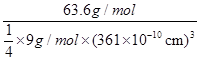 =6.01×1023mol-1(3分)
=6.01×1023mol-1(3分)
(2)离子键、共价键、配位健(2分) 正四面体(1分) sp3杂化(1分)
(3)F>O>N(2分) Cu2O、Cu2S都是离子晶体,O2-半径比S2-半径小,阴阳离子的核间距小,晶格能大,熔点高(2分)
(4)Cu+H2O2+4NH3=[Cu(NH3)4](OH)2(2分)
(5)NA=
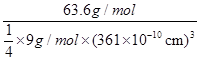 =6.01×1023mol-1(3分)
=6.01×1023mol-1(3分)试题分析:(1)Sn位于元素周期表的第五周期第ⅣA族,所以根据构造原理可知,锡原子的价电子排布式是5s25p2。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,该晶体是[Cu(NH3)4]SO4,属于配位化合物,含有的化学键是离子键、共价键、配位健。根据价层电子对互斥理论可知,SO2—4中S原子含有的孤对电子对数=(6+2-4×2)÷2=0,所以SO2—4的立体构型是正四面体,其中S原子的杂化轨道类型是sp3杂化。
(3)非金属性越强,电负性越大,所以N、O、F三种元素的电负性由大到小的顺序为F>O>N。由于Cu2O和Cu2S都是离子晶体,O2-半径比S2-半径小,阴阳离子的核间距小,晶格能大,所以Cu2O的熔点高于Cu2S。
(4)铜具有还原性,双氧水具有氧化性,而铜离子极易与氨气形成配位健,所以铜可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为Cu+H2O2+4NH3=[Cu(NH3)4](OH)2。
(5)晶胞为面心立方最密堆积,则晶胞中铜原子的个数是8×
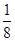 +6×
+6×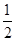 =4。晶胞的边长为361pm,铜的密度为9.00g.cm-3,则
=4。晶胞的边长为361pm,铜的密度为9.00g.cm-3,则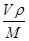 ×NA=4,因此阿伏加德罗常数为NA=
×NA=4,因此阿伏加德罗常数为NA=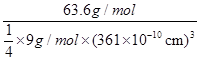 =6.01×1023mol-1。
=6.01×1023mol-1。
练习册系列答案
相关题目
 2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。
2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。 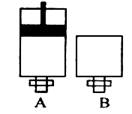

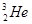 ,而在地球上氦元素则主要以
,而在地球上氦元素则主要以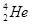 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是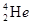 原子核内含有4个质子
原子核内含有4个质子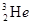 与
与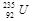 是重要的核工业原料,在自然界中的含量很低。下列有关铀
是重要的核工业原料,在自然界中的含量很低。下列有关铀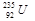 的说法正确的是
的说法正确的是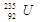 与
与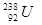 的性质完全相同
的性质完全相同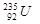 原子核中含有143个中子
原子核中含有143个中子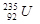 属于短周期元素
属于短周期元素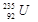 的质量是143g
的质量是143g