题目内容
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2表示从0~2s内该反应的平均速率v= 。
|
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正 (O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
(1)0.0015 (2)b (3)BC (4) c
解析:(1)反应速率通常由单位时间内浓度的变化量来表示。从0~2s内NO减少了0.020mol-0.008mol=0.012mol,则消耗氧气0.006mol,用O2表示从0~2s内该反应的平均速率v=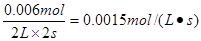 。
。
(2)NO2是生成物,在2s时根据(1)可知生成了0.012mol,其浓度为0.006mol/L,所以曲线b正确。
(3)NO2的和氧气的反应速率之比始终是2︰1,A不正确。反应前后体积是变化的,即压强也是变化的,所以B可以说明。在选项C中反应速率的方向是相反的,且满足速率之比是相应的化学计量数之比,正确。密度是气体的质量和容器体积的比值,因为在反应过程中气体质量和容器体积均不变,所以密度始终不变。
(4)A中降低生成物浓度,反应速率降低。升高温度,平衡向逆反应方向移动。催化剂不能改变平衡状态,增大反应物浓度,平衡向正反应方向移动,正确,所以答案是C。

在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2表示从0~2s内该反应的平均速率v= 。
|
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正 (O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2表示从0~2s内该反应的平均速率v= 。
|
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆 (NO)=2v正 (O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
(9分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是________.用O2表示从0~2 s内该反应的平均速率v=________
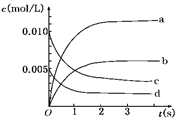
(3)能说明该反应已达到平衡状态的是________.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
粗颗粒 |
|
|
|
④ |
|
|
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= ;
(2)用O2表示从0~2s内该反应的平均反应速率为 ;
(3)右图中表示NO2变化的曲线是 ;

(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V ②体积不变充入He气体 V
(12分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  ?2NO2(g)体系中,n(NO)随时间的变化如下表:
?2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
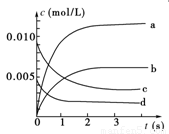
(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_____ ___。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂