题目内容
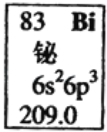
【题目】某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1moLL﹣1NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为( ) 
A.1:1:1
B.2:2:1
C.2:1:1
D.1:1:2
【答案】B
【解析】解:假定NaOH溶液的浓度为cmol/L,则:
根据图象知,横坐标为0﹣10mL时发生的反应是:H++OH﹣=H2O,加入10mLNaOH溶液结合中和氢离子,n(H+)=n(NaOH)=0.01L×cmol/L=0.01cmol;
横坐标为50﹣60mL时,发生的化学反应是:Al(OH)3+OH﹣=AlO2﹣+2H2O,Al(OH)3完全溶解消耗消耗10mLNaOH溶液,由方程式可知n[Al(OH)3]=n(NaOH)=0.01L×cmol/L=0.01c,再根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=0.01cmol;
横坐标为10﹣50mL时发生的化学反应是:Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据OH﹣守恒,2n[Mg(OH)2]+3n[Al(OH)3]=n(NaOH),故2n[Mg(OH)2]+0.03c=0.04L×cmol/L,故n[Mg(OH)2]=0.005cmol,
则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为0.01c:0.01c:0.005c=2:2:1,
故选B.

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是( )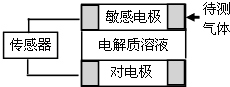
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2+2e﹣═2Cl﹣
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e﹣═4OH﹣
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同