题目内容
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体形、三角锥形、正四面体形、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: 、 、 。
(3)D和Y形成的化合物分子的空间构型为 。
(4)D和X形成的化合物的化学键类型是 ,其晶体类型是 。
(5)试比较D和X的最高价氧化物熔点的高低并说明理由: 。
(1)Y的最高价氧化物的化学式为 。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: 、 、 。
(3)D和Y形成的化合物分子的空间构型为 。
(4)D和X形成的化合物的化学键类型是 ,其晶体类型是 。
(5)试比较D和X的最高价氧化物熔点的高低并说明理由: 。
(1)SO3
(2)Cl HClO、HClO2、HClO3、HClO4(任写3种即可)
(3)直线形
(4)共价键 原子晶体
(5)D的最高价氧化物是CO2,X的最高价氧化物是SiO2,前者比后者的熔点低。因为前者为分子晶体,由分子间作用力结合,而后者为原子晶体,由共价键结合,共价键强度大于分子间作用力。
(2)Cl HClO、HClO2、HClO3、HClO4(任写3种即可)
(3)直线形
(4)共价键 原子晶体
(5)D的最高价氧化物是CO2,X的最高价氧化物是SiO2,前者比后者的熔点低。因为前者为分子晶体,由分子间作用力结合,而后者为原子晶体,由共价键结合,共价键强度大于分子间作用力。
由于D、E、X、Y、Z原子序数依次增大,它们的最简氢化物分子的空间构型依次为正四面体形、三角锥形、正四面体形、角形(V形)、直线形。因此D、E、X、Y、Z分别为C、N、Si、S、Cl五种元素。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
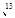 C;氧也有常见的三种同位素16O、17O、18O。由这5种粒子构成的二氧化碳分子中,其相对分子质量最多可能有( )。
C;氧也有常见的三种同位素16O、17O、18O。由这5种粒子构成的二氧化碳分子中,其相对分子质量最多可能有( )。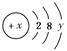 ,试回答:
,试回答: