题目内容
(1)合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3.当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高.以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C=4FeO+CO2↑.为制得这种活性最高的催化剂,应向480gFe2O3粉末中加入炭粉的质量为________g.
(2)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,发生反应如下:
MnO4-+Cu2S+H+→Cu2++SO2++Mn2++H2O
MnO4-+CuS+H+→Cu2++SO2++Mn2++H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应(KMnO4的还原产物为Mn2+).
则Cu2S和CuS的混合物中Cu2S的质量分数为________.
(3)已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
N2O(1)=H2O(g);△H=+44kJ/mol
发射卫星用肼(即N2H4)的气体为原料,以NO2气体为氧化剂,两种物质反应生成氮气和液态水,试写出该反应的热化学方程式:________.
(4)用24.5%硫酸溶液(密度为1.20g/cm3)配制100ml0.20mol/L硫酸溶液时,要用到的玻璃仪器有:容量瓶、酸式滴定管、烧杯、胶头滴管和________.使用容量瓶时应先检查其是否________;用刚洗净的酸式滴定管量取24.5%硫酸溶液时,应先________,然后量取________mL24.5%硫酸溶液进行配制.
(5)现有足量铝屑、含1molH2SO4的浓硫酸、含1.5molNaOH的氢氧化钠溶液和水.①若用上述原料制取氢气,有以下两个方案:
方案一:用铝屑和氢氧化钠溶液制取氢气
方案二:用铝屑、浓硫酸和水制取氢气
你认为最好的方案是________其理由是:________.
②制取氢氧化铝可以有几种不同的方法.若用上述原料最多能制得________gAl(OH)3
解析:
(1)6克(3分)
(2)40%(3分)
(3)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1);△H=-1311.7kJ/mol(3分)
(4)玻璃棒(1分);漏水(1分);用24.5%硫酸润洗(2分);6.67(2分)
(5)方案一(1分),生成氢气比方案二多且实验操作简便(2分),156(3分)

 轻松夺冠全能掌控卷系列答案
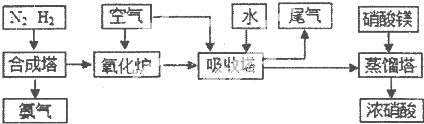
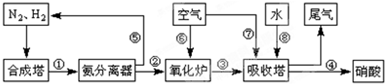
轻松夺冠全能掌控卷系列答案工业合成氨与制备硝酸一般可连续生产,流程如下:

请回答下列问题:
(1)工业生产时,制取氢气的一个反应为:
C0+H2O(g)?CO2+H2 t℃时,向 1L密闭容器中充入0.2molCO和0.3mol水蒸气.反应达到平衡后,体系中c(H2)=0.12mol?L-1,该温度下此反应的平衡常数K=
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙从而进行回收.当处理后的废水中c(Ca2+)=2×10-7mol/L时,处理后的废水中c(PO43-)≤
②方法二:在废水中加入镁矿工业废水,就可以生成髙品位的磷矿石一鸟粪石,反应的离子方程式为Mg2++NH4++PO43-═MgNH4PO4↓.该方法中需要控制污水的pH为7.5?10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
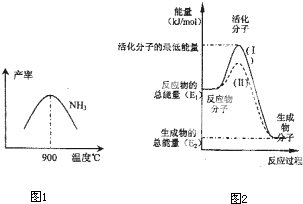
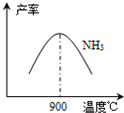 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因