题目内容
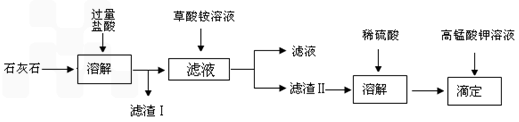
石灰石的主要成份是碳酸钙,含氧化钙约 40~50%,较好的石灰石含 CaO 约 45~53%.此外还有 SiO2、Fe2O3、Al2O3 及 MgO 等杂质.测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC2O4?H2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量. 涉及的化学反应为:
H2C2O4+MnO4-+H+→Mn2++CO2↑+H2O(未配平)
CaC2O4 沉淀颗粒细小,易沾污,难于过滤.为了得到纯净而粗大的结晶,通常在含 Ca2+的酸性溶液中加入饱和 (NH4)2C2O4,由于 C2O42- 浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中 C2O42- 浓度慢慢增大,可以获得颗粒比较粗大的 CaC2O4 沉淀.沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使 CaC2O4 溶解度太大.
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
(2)沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
(4)写出硫酸溶解草酸钙沉淀的离子方程式:
(5)若开始用去m g样品,最后滴定用去浓度为C mol/L 的KMnO4 溶液 v ml,推出CaO含量与 KMnO4的定量计算关系.ω%= .
H2C2O4+MnO4-+H+→Mn2++CO2↑+H2O(未配平)
CaC2O4 沉淀颗粒细小,易沾污,难于过滤.为了得到纯净而粗大的结晶,通常在含 Ca2+的酸性溶液中加入饱和 (NH4)2C2O4,由于 C2O42- 浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中 C2O42- 浓度慢慢增大,可以获得颗粒比较粗大的 CaC2O4 沉淀.沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使 CaC2O4 溶解度太大.
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
(2)沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
(4)写出硫酸溶解草酸钙沉淀的离子方程式:
(5)若开始用去m g样品,最后滴定用去浓度为C mol/L 的KMnO4 溶液 v ml,推出CaO含量与 KMnO4的定量计算关系.ω%=
分析:(1)根据石灰石中的各成分与盐酸反应生成物的溶解性进行解答;
(2)因饱和的 (NH4)2C2O4 溶液可将Ca2+充分反应,沉淀完全;
(3)根据草酸钙的固体溶解平衡影响因素解答;
(4)硫酸溶解草酸钙沉淀生成草酸、硫酸钙和水;
(5)根据5CaC2O4~5H2C2O4~2MnO4-计算.
(2)因饱和的 (NH4)2C2O4 溶液可将Ca2+充分反应,沉淀完全;
(3)根据草酸钙的固体溶解平衡影响因素解答;
(4)硫酸溶解草酸钙沉淀生成草酸、硫酸钙和水;
(5)根据5CaC2O4~5H2C2O4~2MnO4-计算.
解答:解:(1)将样品溶于盐酸,碳酸钙和盐酸反应生成易溶于水的氯化钙和水,氧化钙和盐酸反应生成氯化钙和水,氧化铝和盐酸反应生成易溶于水的氯化铝和水,氧化镁和盐酸反应生成氯化镁和水,二氧化硅和盐酸不反应,沉淀物主要是SiO2;
故答案为:SiO2;
(2)(NH4)2C2O4+CaCl2=CaC2O4↓+2NH4Cl,加饱和的 (NH4)2C2O4 溶液可将Ca2+充分反应,沉淀完全;
故答案为:保持较大的C2O42-离子浓度,使Ca2+沉淀完全;
(3)草酸钙的溶解平衡为:CaC2O4(s)?Ca2+(aq)+C2O42-(aq),用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,可降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差;
故答案为:降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差;
(4)成难溶的草酸钙沉淀 为CaC2O4?H2O,和硫酸混合反应生成草酸,硫酸钙和水,反应的离子方程式为:CaC2O4?H2O+2H+=Ca2++H2C2O4+H2O;
故答案为:CaC2O4?H2O+2H+=Ca2++H2C2O4+H2O;
(5)高锰酸钾与草酸发生氧化还原反应,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
5CaC2O4~5H2C2O4~2MnO4-
5mol 2mol
n Cmol/L×V×10-3L
n=2.5CV×10-3mol,则m(CaO)=2.5CV×10-3mol×56g/mol=0.14CVg,m g样品中含氧化钙为:
或
%;
故答案为:
或
%;
故答案为:SiO2;
(2)(NH4)2C2O4+CaCl2=CaC2O4↓+2NH4Cl,加饱和的 (NH4)2C2O4 溶液可将Ca2+充分反应,沉淀完全;
故答案为:保持较大的C2O42-离子浓度,使Ca2+沉淀完全;
(3)草酸钙的溶解平衡为:CaC2O4(s)?Ca2+(aq)+C2O42-(aq),用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,可降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差;
故答案为:降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差;
(4)成难溶的草酸钙沉淀 为CaC2O4?H2O,和硫酸混合反应生成草酸,硫酸钙和水,反应的离子方程式为:CaC2O4?H2O+2H+=Ca2++H2C2O4+H2O;
故答案为:CaC2O4?H2O+2H+=Ca2++H2C2O4+H2O;
(5)高锰酸钾与草酸发生氧化还原反应,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
5CaC2O4~5H2C2O4~2MnO4-
5mol 2mol
n Cmol/L×V×10-3L
n=2.5CV×10-3mol,则m(CaO)=2.5CV×10-3mol×56g/mol=0.14CVg,m g样品中含氧化钙为:
| 0.14CV |
| m |
| 14CV |
| m |
故答案为:
| 0.14CV |
| m |
| 14CV |
| m |
点评:本题主要考查了实验操作和石灰石成分的分析,明确实验步骤和原理,是正确解答此类问题的前提,题目难度中等.

练习册系列答案
相关题目