题目内容
2.24 g铁与100 mL稀硝酸混合后充分反应,产生的气体为NO,铁、硝酸均无剩余。向反应后的溶液中加入50.00 mL 0.200 mol·L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原。求原硝酸溶液的物质的量浓度。
1.2 mol·L-1
解析:由Fe3+得电子的物质的量等于I-失电子的物质的量,有:n(I-)=0.200 mol·L-1×0.0500 L=0.0100 mol
所以n(Fe3+)=0.0100 mol
而n(Fe)=![]() =0.0400 mol
=0.0400 mol
所以n(Fe2+)=0.0400 mol-0.0100 mol=0.0300 mol
再由氧化剂HNO3得电子的物质的量等于Fe失电子的物质的量,即:n(Fe2+)×2+n(Fe3+)×3=n(NO)×3
所以n(NO)=![]() =0.0300 mol,所以参加反应的HNO3的物质的量为:
=0.0300 mol,所以参加反应的HNO3的物质的量为:
n(HNO3)=0.0300 mol+0.0300 mol×2+0.0100 mol×3=0.120 mol,所以HNO3的浓度为c(HNO3)=![]() =1.20 mol·L-1。
=1.20 mol·L-1。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
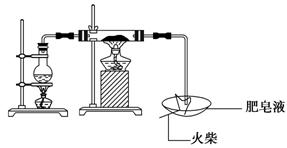
 高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应)。
高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应)。