题目内容
钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为 g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量。
(4)KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为 g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量。
(4)KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
(1)28.2g
(2)96.25%
(3)71g
(4)KxOy+x/2CO2→x/2K2CO3+(y-0.5x)/02
39x+16y 11.2(y-0.5x)
6.3 1.12
解得x︰y=2︰3 即n(K)︰n(O)=2︰3
即得化学式为:(KO2与K2O2 2︰1) (KO2与K2O 4︰1)
(2)96.25%
(3)71g
(4)KxOy+x/2CO2→x/2K2CO3+(y-0.5x)/02
39x+16y 11.2(y-0.5x)
6.3 1.12
解得x︰y=2︰3 即n(K)︰n(O)=2︰3
即得化学式为:(KO2与K2O2 2︰1) (KO2与K2O 4︰1)
此题考查的是化学基本计算能力。
解:(1)设10.1g硝酸钾反应需要Kxg,反应生成K2Oyg
10K + 2KNO3→ 6K2O+ N2
202 564
x 10.1 y
解得x="19.5" <39 钾过量, y=28.2
(2)设样品中含K2O21mol,杂质质量为a克,由题意得:
(110+a) ×0.28=110×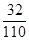
解得:a="4.29"
w(K2O2)="110÷(110+4.29)" ×100% =96.25%
(3)设反应消耗KO2 z克
4KO2+2CO2→2K2CO3+3O2 ΔV
284 44.8 67.2 22.4
z 18.8-13.2
解得:z=71
(4)KxOy+x/2CO2→x/2K2CO3+(y-0.5x)/02
39x+16y 11.2(y-0.5x)
6.3 1.12
解得x︰y=2︰3 即n(K)︰n(O)=2︰3
即得化学式为:(KO2与K2O2 2︰1) (KO2与K2O 4︰1)
【思路点拨】(1)小题为过量计算,(2)小题为质量分数计算;(3)小题为物质的量计算和差量计算;(4)为计算推断
解:(1)设10.1g硝酸钾反应需要Kxg,反应生成K2Oyg
10K + 2KNO3→ 6K2O+ N2
202 564
x 10.1 y
解得x="19.5" <39 钾过量, y=28.2
(2)设样品中含K2O21mol,杂质质量为a克,由题意得:
(110+a) ×0.28=110×
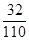
解得:a="4.29"
w(K2O2)="110÷(110+4.29)" ×100% =96.25%
(3)设反应消耗KO2 z克
4KO2+2CO2→2K2CO3+3O2 ΔV
284 44.8 67.2 22.4
z 18.8-13.2
解得:z=71
(4)KxOy+x/2CO2→x/2K2CO3+(y-0.5x)/02
39x+16y 11.2(y-0.5x)
6.3 1.12
解得x︰y=2︰3 即n(K)︰n(O)=2︰3
即得化学式为:(KO2与K2O2 2︰1) (KO2与K2O 4︰1)
【思路点拨】(1)小题为过量计算,(2)小题为质量分数计算;(3)小题为物质的量计算和差量计算;(4)为计算推断

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

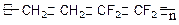 )是由两种单体缩聚而成的
)是由两种单体缩聚而成的 Na+不能共存
Na+不能共存