题目内容
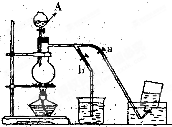
 如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.
如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.(1)仪器A的名称是
分液漏斗
分液漏斗
;烧杯中盛放的是
氢氧化钠溶液
氢氧化钠溶液
;烧瓶中发生的反应化学方程式为
MnO2+4HCl
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl
MnCl2+Cl2↑+2H2O
;
| ||
(2)在收集氯气时,应
关闭b,打开a
关闭b,打开a
.(填:如何操作a、b止水夹,下同),当氯气收集完毕时应关闭a,打开b
关闭a,打开b
.(3)若制得标准状况下的Cl2为0.672L,则被氧化的HCl的物质的量是
0.06mol
0.06mol
.分析:(1)实验室常用二氧化锰和浓盐酸在加热条件下生成氯气,氯气有毒,用氢氧化钠溶液吸收;
(2)收集氯气时,应关闭b,打开a,用排饱和食盐水法收集;收集完毕,关闭a,打开b,用氢氧化钠溶液吸收多余氯气;
(3)根据氯气的体积求出氯气的物质的量,从而求出被氧化的HCl的物质的量.
(2)收集氯气时,应关闭b,打开a,用排饱和食盐水法收集;收集完毕,关闭a,打开b,用氢氧化钠溶液吸收多余氯气;
(3)根据氯气的体积求出氯气的物质的量,从而求出被氧化的HCl的物质的量.
解答:解:(1)根据仪器特点可知A为分液漏斗;因为氯气有毒,可污染空气,要进行尾气吸收,并且氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以常用氢氧化钠溶液吸收尾气中,烧杯中盛放氢氧化钠溶液;实验室常用二氧化锰和浓盐酸在加热条件下生成氯气,反应的化学方程式为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
(2)氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气,收集时,应关闭b,打开a;收集完毕,关闭a,打开b,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气;
(3)n(Cl2)=
=
=0.03mol;
生成0.03molCl2参加反应的HCl的物质的量为x;
MnO2+4HCl
MnCl2+Cl2↑+2H2O
4 1
x 0.03mol
=
x=0.12mol
被氧化的HCl的物质的量=0.12mol×
=0.06mol.
故答案为:(1)分液漏斗;氢氧化钠溶液;MnO2+4HCl
MnCl2+Cl2↑+2H2O;
(2)关闭b,打开a;关闭a,打开b;
(3)0.06mol.
| ||
(2)氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气,收集时,应关闭b,打开a;收集完毕,关闭a,打开b,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气;
(3)n(Cl2)=
| V |
| Vm |
| 0.672L |
| 22.4L?mol-1 |
生成0.03molCl2参加反应的HCl的物质的量为x;
MnO2+4HCl
| ||
4 1
x 0.03mol
| 4 |
| 1 |
| x |
| 0.03mol |
被氧化的HCl的物质的量=0.12mol×
| 1 |
| 2 |
故答案为:(1)分液漏斗;氢氧化钠溶液;MnO2+4HCl
| ||
(2)关闭b,打开a;关闭a,打开b;
(3)0.06mol.
点评:本题考查氯气的实验室制法,在收集有毒的气体时要在收集装置后面加一个尾气处理装置,防止污染空气.

练习册系列答案
相关题目
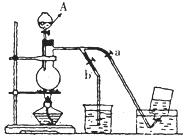 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)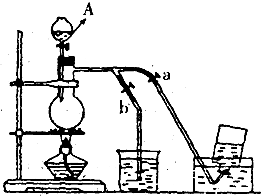 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a.b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a.b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)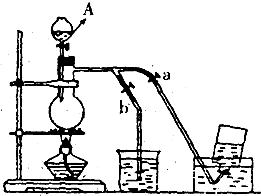 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a.b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a.b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)