题目内容
【题目】实验室用下图所示装置制备AlCl3溶液,并用AlCl3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后煅烧沉淀制备新型的超导材料和发光材料七铝十二钙(12CaO·7Al2O3)。已知AlCl3易水解,易升华。

(1)实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为 ;C装置的作用 。
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中浓盐酸,为了防止AlCl3蒸气凝华堵塞导管,实验中可采取的措施是 (写出一点)。
(3)AlCl3溶液溶解CaCO3时,AlCl3溶液和碳酸钙粉末的混合方式为 。
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 。
(5)用白云石(主要成分为CaCO3、MgCO3)制备纯净碳酸钙的实验方案为:将一定量的白云石煅烧, 。(实验中需用到的试剂有:硝酸铵溶液,氨气,二氧化碳;需要用到的仪器:pH计。已知:镁的化合物不溶于硝酸铵溶液;pH值为11~12时得到较纯净碳酸钙沉淀)。
【答案】(1)ClO3-+5Cl-+6H+=3Cl2+3H2O 吸收氯气,防止污染空气 (2)加粗导管、缩短导管长度、加热导管、通入氮气等 (3)碳酸钙粉末慢慢加入到AlCl3溶液中 (4)氢氧化钙微溶于水,造成损失 (5)用硝酸铵溶液溶解煅烧后的固体,过滤,向所得滤液中通入二氧化碳,调节PH值11-12,过滤出碳酸钙沉淀
【解析】
试题分析:(1)实验室用氯酸钾氧化浓盐酸制备氯气,生成氯气和氯化钾及水,反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2+3H2O,实验中有氯气尾气,会污染空气,所以用C装置中氢氧化钠进行尾气吸收,吸收氯气,防止污染空气;
(2)AlCl3易水解,所以吸收氯化铝要用盐酸溶液,为了防止AlCl3蒸气凝华堵塞导管,实验中加粗导管、缩短导管长度、加热导管、通入氮气等;
(3)B装置中的AlCl3溶液溶解CaCO3时,AlCl3溶液水解呈酸性,所以在混合时可以将碳酸钙粉末慢慢加到氯化铝溶液中,便于碳酸钙溶解;
(4)由于氢氧化钙微溶于水,钙元素会有损失,所以碳酸钙要适当过量;
(5)用白云石(主要成分为CaCO3、MgCO3)制备纯净碳酸钙,要除去原料中的镁离子,由于镁的化合物不溶于硝酸铵溶液,所以要除去碳酸镁,先将固体煅烧,再用硝酸铵溶液溶解煅烧后的固体,然后过滤,向所得滤液中通入二氧化碳,调节PH值11-12,过滤可得碳酸钙沉淀。

【题目】一定条件下反应:2A(g)+B(g) ![]() 3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
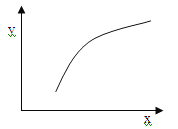
选项 | x | y |
A | A的浓度 | 平衡常数K |
B | 温度 | 混合气体的密度 |
C | B的物质的量 | A的转化率 |
D | 催化剂的质量 | C的体积分数 |