题目内容
从含镁、钾盐湖水中蒸发最后得到产物中含光卤石(xKCl·yMgCl2·zH2O),它是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550g样品溶于水,配成100.0mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干
燥至恒重,得到白色固体0.580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥
至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是: 。
(2)已知某温度下Mg(OH)2的Ksp=6.4×l0?12,当溶液中c(Mg2+)≤1.0×10?5mol·L?1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥ mol·L?1。
(3)通过计算确定样品的组成(写出计算过程)。
①准确称取5.550g样品溶于水,配成100.0mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干
燥至恒重,得到白色固体0.580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥
至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是: 。
(2)已知某温度下Mg(OH)2的Ksp=6.4×l0?12,当溶液中c(Mg2+)≤1.0×10?5mol·L?1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥ mol·L?1。
(3)通过计算确定样品的组成(写出计算过程)。
(1)取最后的洗涤液,滴加AgNO3溶液,若不产生沉淀,则已洗净(2分)。
(2)8×10—4(2分)
(3)5.550g样品中含:
n(Mg2+)=
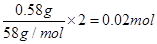 n(MgCl2)=0.02mol (2分)
n(MgCl2)=0.02mol (2分)n(Cl—)=
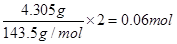
n(KCl)=0.06mol-2×0.02mol=0.02mol (2分)
n(H2O)=
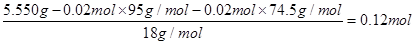
样品中n(KCl)∶n(MgCl2)∶n(H2O) =1∶1∶6
光卤石的化学式为:KCl·MgCl2·6H2O (1分)
试题分析:(1)实验中洗涤是在过滤后在过滤器中进行,故应去最后一次的洗涤液检验:取最后的洗涤液,滴加AgNO3溶液,若不产生沉淀,则已洗净;(2)直接根据溶度积关系式计算;
(3)第一步实验计算镁离子的量
n(Mg2+)=
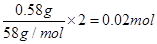 n(MgCl2)=0.02mol (2分)
n(MgCl2)=0.02mol (2分)第二步实验计算氯离子的量n(Cl—)=
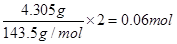
然后根据电荷守恒计算钾离子的量,n(KCl)=0.06mol-2×0.02mol=0.02mol
最后根据质量关系确定水的量,
n(H2O)=
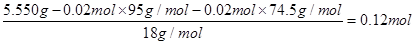
根据各物质的量的比值得出化学式。样品中n(KCl)∶n(MgCl2)∶n(H2O) =1∶1∶6
光卤石的化学式为:KCl·MgCl2·6H2O

练习册系列答案
相关题目
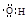 )中含有的电子数为0.7 NA
)中含有的电子数为0.7 NA