题目内容
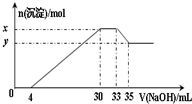 (2011?金台区模拟)在200mL含Mg2+、Al3+、NH4+、H+、Cl- 等离子的溶液中,逐滴加入5mol?L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述不正确的是( )
(2011?金台区模拟)在200mL含Mg2+、Al3+、NH4+、H+、Cl- 等离子的溶液中,逐滴加入5mol?L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述不正确的是( )分析:由给出的离子在滴入NaOH溶液时发生H++OH-═H2O,Mg2+、Al3+结合OH-生成沉淀,NH4+与OH-反应,氢氧化铝与OH-反应而溶解,并结合图象可知,0~4mL时发生酸碱中和,4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,30mL~33mL发生NH4+与OH-反应,33mL~35mL发生氢氧化铝的溶解反应,然后利用离子反应方程式来计算解答.
解答:解:A、由图及离子反应可知x-y的值即为Al(OH)3的物质的量,
则设Al(OH)3的物质的量为n,
Al(OH)3+OH-═AlO2-+2H2O
1 1
n (35-33)×0.001L×5mol?L-1
=
,
解得n=0.01mol,即x-y=0.01mol,故A说法正确;
B、由图可知,加入33mLNaOH溶液时Cl-离子以NaCl存在,
设Cl-离子的物质的量为z,由钠和氯原子守恒可知
NaOH~NaCl~Cl-,
1 1
33×0.001L×5mol?L-1 z
=
,解得z=0.165mol,
则原溶液中Cl-的物质的量浓度为
=0.825mol/L,故B说法不正确;
C、由图0~4mL时发生H++OH-═H2O,
则H+的物质的量为4mL×0.001L×5mol?L-1=0.02mol,
H+的物质的量浓度为
=0.1mol/L,则pH=1,故C说法正确;
D、由4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,
则 Al3++3OH-═Al(OH)3↓
1 3 1
0.01mol 0.03mol 0.01mol
设镁离子的物质的量为m,
Mg2++2OH-═Mg(OH)2↓
1 2
m (30-4)mL×0.001L×5mol?L-1-0.03mol
=
,解得m=0.05mol,
则原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,故D说法正确;
故选:B.
则设Al(OH)3的物质的量为n,
Al(OH)3+OH-═AlO2-+2H2O
1 1
n (35-33)×0.001L×5mol?L-1
| 1 |
| 1 |
| n |
| (35-33)×0.001L× 5mol/L |
解得n=0.01mol,即x-y=0.01mol,故A说法正确;
B、由图可知,加入33mLNaOH溶液时Cl-离子以NaCl存在,
设Cl-离子的物质的量为z,由钠和氯原子守恒可知
NaOH~NaCl~Cl-,
1 1
33×0.001L×5mol?L-1 z
| 1 |
| 1 |
| z |
| 33×0.001L× 5mol/L |
则原溶液中Cl-的物质的量浓度为
| 0.165mol |
| 0.2L |
C、由图0~4mL时发生H++OH-═H2O,
则H+的物质的量为4mL×0.001L×5mol?L-1=0.02mol,
H+的物质的量浓度为
| 0.02mol |
| 0.2L |
D、由4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,
则 Al3++3OH-═Al(OH)3↓
1 3 1
0.01mol 0.03mol 0.01mol
设镁离子的物质的量为m,
Mg2++2OH-═Mg(OH)2↓
1 2
m (30-4)mL×0.001L×5mol?L-1-0.03mol
| 1 |
| 2 |
| m |
| (30-4)mL×0.001L×5mol?/L-0.03mol |
则原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,故D说法正确;
故选:B.
点评:本题难度较大,考查溶液中的离子反应及对应图象关系,明确反应的先后顺序是解答的关键,并注意反应与图象中的对应关系来解答即可.

练习册系列答案
相关题目
 (2011?金台区模拟)下列关于如图装置的说法错误的是( )
(2011?金台区模拟)下列关于如图装置的说法错误的是( )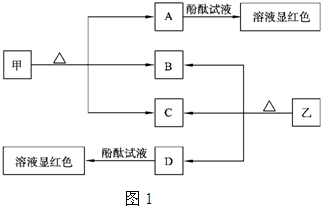

 C3H6N6+6 NH3+3 CO2
C3H6N6+6 NH3+3 CO2