题目内容
(14分)某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
(1)用下列实验装置制取干燥纯净的氯气
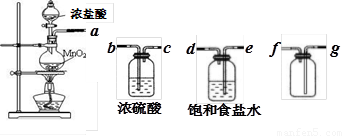
①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为
(填仪器接口的字母编号)
②该实验还存在不足之处,应如何改进?
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②: ;假设③: 。
②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
|
实验方法 |
实验现象 |
结论 |
|
在溶液中加 KSCN溶液 |
|
固体物质中有FeCl3 |
|
向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含______ |
由此得出结论:假设 成立(填序号①②③)。
(3)为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_____________(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Fe(OH)3溶解度小于Mg(OH)2溶解度
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
(4)a溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如右图的装置从得到的废液中提炼金属铜。该过程中甲池负极的电极反应式是 ,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积
(标准状况)为 (假设气体全部逸出)。

(14分)(1)①aedbcgf (2分) ②在C后接NaOH溶液尾气处理装置(1分)
(2)(1)FeCl2(1分);FeCl3和FeCl2的混合物(1分)
(2)
|
实验方法 |
实验现象 |
结论 |
|
在溶液中加 KSCN溶液 |
溶液为红色(1分) |
固体物质中有FeCl3 |
|
向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含 FeCl2(1分) |
由此得出结论:假设 ① 结论成立(1分)
(3)A D(2分)
(4)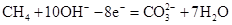 (2分),1.12L(2分)
(2分),1.12L(2分)
【解析】(1)①由于浓盐酸易挥发,所以生成的氯气中含有氯化氢,可以通过饱和食盐水除去。干燥氯气可以浓硫酸。由于氯气的密度大于空气的,所以应该用向下排空气发收集,即正确的顺序是aedbcgf 。
②由于氯气是有毒气体,应该有尾气处理装置,即在C后接NaOH溶液尾气处理装置。
(2)①由于铁元素有两种价态+2价和+3价,所以假设2和3分别是FeCl2;FeCl3和FeCl2的混合物。
②在溶液中铁离子能和KSCN溶液发生反应,使溶液显红色;酸性高锰酸钾溶液具有强氧化性,能氧化亚铁离子。由于实验中酸性高锰酸钾溶液不褪色,说明固体中不存在氯化亚铁,因此假设①是正确的。
(3)根据沉淀转化的特点:向溶解度更小的方向转化可知,选项A正确;B不正确,氯化亚铁在溶液中显浅绿色,因此实验现象应该是溶液颜色由黄色变成浅绿色;C不正确,得到的是氢氧化铁胶体;氯化铁水解,加热促进水解,且氯化氢极易挥发,实验最终得到的是氢氧化铁,灼烧得到氧化铁,D正确,答案选AD。
(4)原电池中负极失去电子,所以甲烷在负极通入。由于电解质是氢氧化钾,因此负极反应式是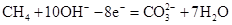 。电解池中阴极铜离子放电,阳极Cl-放电,电极反应式分别是Cu2++2e-=Cu、2Cl--2e-=Cl2↑。生成铜是3.2g,转移电子是0.1mol,所以生成氯气是0.05mol,标准状况下的体积是0.05mol×22.4L/mol=1.12L。
。电解池中阴极铜离子放电,阳极Cl-放电,电极反应式分别是Cu2++2e-=Cu、2Cl--2e-=Cl2↑。生成铜是3.2g,转移电子是0.1mol,所以生成氯气是0.05mol,标准状况下的体积是0.05mol×22.4L/mol=1.12L。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案(08杭州第十中学月考)某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应.
(1)在甲酸进行银镜反应前,必须在其中加入一定量的 ,因为 .
(2)写出甲酸进行银镜反应的化学方程式 .
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作 (写字母):
A、用洁净的试管;
B、在浓度为2%的NH3?H2O中滴入稍过量的浓度为2%的硝酸银;
C、用前几天配制好的银氨溶液;
D、在银氨溶液里加入稍过量的甲酸;
E、用小火对试管直接加热;
F、反应过程中,振荡试管使之充分反应.
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
 |
(4)乙装置中长导管A的作用是
(5)写出甲酸和甲醇进行酯化反应的化学方程式
(6)选择甲装置还是乙装置好? ,原因是 .
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有 、
两种必备用品.
(8)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释