题目内容
向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,求原溶液中Fe3+的物质的量浓度.
解:开始产生沉淀至沉淀量达最大值发生反应:
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
AlCl3+3NaOH=Al(OH)3↓+3NaCl
继续加入NaOH溶液,沉淀开始溶解至沉淀完全不再减少发生反应:
Al(OH)3+NaOH=NaAlO2+2H2O
沉淀开始溶解至沉淀完全不再减少,使用NaOH的物质的量为(b-a)mol,Al(OH)3与NaOH发生反应的物质的量之比是
1:1,所以,Al(OH)3的物质的量是(b-a)mol;
根据方程式:AlCl3+3NaOH=Al(OH)3↓+3NaCl,当有(b-a)molAl(OH)3生成时,需要NaOH的物质的量是
Al(OH)3的3倍,所以需要NaOH的物质的量是3(b-a)molAl;
与氯化铁反应的NaOH的物质的量为amol-3(b-a)mol=(4a-3b)mol,
根据反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl知,生成Fe(OH)3所用NaOH物质的量是FeCl3的3倍,
所以FeCl3的物质的量是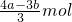 ,
,
因为溶液的体积是1L,所以FeCl3的物质的量浓度是: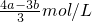 ,
,
故答案为: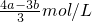
分析:沉淀量由最大到不再减少变化的量是Al(OH)3,结合方程式利用氢氧化钠的物质的量求出Al(OH)3的物质的量,根据
Al(OH)3的物质的量求出生成Al(OH)3所用NaOH的物质的量,产生的沉淀量达最大值时使用的氢氧化钠的物质的量减去生成Al(OH)3所用NaOH的物质的量,就是生成Fe(OH)3时使用的氢氧化钠的物质的量,再根据方程式求出FeCl3的物质的量,根据物质的量浓度浓度公式求出浓度即可.
点评:本题过程复杂,结合方程式分析较好,如果结合图象分析更佳,可用此图象结合分析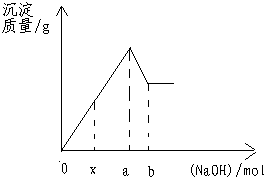
x点表示与FeCl3反应所需的氢氧化钠的物质的量,a--x表示与AlCl3反应所需NaOH的物质的量,(a-x)的量是(b-a)的3倍.
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
AlCl3+3NaOH=Al(OH)3↓+3NaCl
继续加入NaOH溶液,沉淀开始溶解至沉淀完全不再减少发生反应:
Al(OH)3+NaOH=NaAlO2+2H2O
沉淀开始溶解至沉淀完全不再减少,使用NaOH的物质的量为(b-a)mol,Al(OH)3与NaOH发生反应的物质的量之比是
1:1,所以,Al(OH)3的物质的量是(b-a)mol;
根据方程式:AlCl3+3NaOH=Al(OH)3↓+3NaCl,当有(b-a)molAl(OH)3生成时,需要NaOH的物质的量是
Al(OH)3的3倍,所以需要NaOH的物质的量是3(b-a)molAl;
与氯化铁反应的NaOH的物质的量为amol-3(b-a)mol=(4a-3b)mol,
根据反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl知,生成Fe(OH)3所用NaOH物质的量是FeCl3的3倍,
所以FeCl3的物质的量是
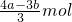 ,
,因为溶液的体积是1L,所以FeCl3的物质的量浓度是:
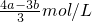 ,
,故答案为:
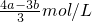
分析:沉淀量由最大到不再减少变化的量是Al(OH)3,结合方程式利用氢氧化钠的物质的量求出Al(OH)3的物质的量,根据
Al(OH)3的物质的量求出生成Al(OH)3所用NaOH的物质的量,产生的沉淀量达最大值时使用的氢氧化钠的物质的量减去生成Al(OH)3所用NaOH的物质的量,就是生成Fe(OH)3时使用的氢氧化钠的物质的量,再根据方程式求出FeCl3的物质的量,根据物质的量浓度浓度公式求出浓度即可.
点评:本题过程复杂,结合方程式分析较好,如果结合图象分析更佳,可用此图象结合分析
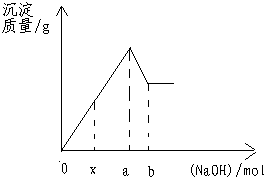
x点表示与FeCl3反应所需的氢氧化钠的物质的量,a--x表示与AlCl3反应所需NaOH的物质的量,(a-x)的量是(b-a)的3倍.

练习册系列答案
相关题目