题目内容
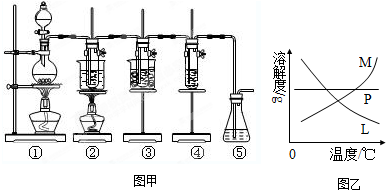
图甲中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为
| ||
| ||
(2)工业上常用氯气与熟石灰反应制漂白粉,漂白粉的有效成分为
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
(4)反应完毕经冷却后,②的试管中有大量晶体析出.图乙中符合该晶体溶解度曲线的是
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性
(6)若②的试管溶液中不但有KClO3生成还有KClO生成,且二者的物质的量之比为1:2,则该反应中氧化剂和还原剂的物质的量之比为:
(2)氯气与熟石灰反应制漂白粉,反应生成氯化钙、次氯酸钙、水;
(3)温度与浓度不同,影响发生的氧化还原反应;
(4)冷却后,②的试管中有大量晶体析出,则其溶解度受温度影响较大,且随温度升高而增大;固体与溶液的分离为过滤;
(5)HClO具有强氧化性;
(6)有KClO3生成还有KClO生成,且二者的物质的量之比为1:2,氧化剂、还原剂均为氯气.
| ||
| ||
(2)氯气与熟石灰反应制漂白粉,反应生成氯化钙、次氯酸钙、水,有效成分为Ca(ClO) 2,故答案为:Ca(ClO) 2;
(3)制取氯酸钾和次氯酸钠的条件有两个不同点:①制取温度不同;②制取时碱的浓度也不同,故答案为:①制取温度不同;②制取时碱的浓度也不同;
(4)冷却后,②的试管中有大量晶体析出,则其溶解度受温度影响较大,且随温度升高而增大,则曲线M符合,固体与溶液的分离为过滤,故答案为:M;过滤;
(5)因HClO具有强氧化性,所以不可证明氯气的强氧化性,因石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2,故答案为:;石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2;
(6)有KClO3生成还有KClO生成,且二者的物质的量之比为1:2,氧化剂、还原剂均为氯气,设KClO3为xmol,KClO为2xmol,KOH为ymol,由电子守恒可知xmol×5+2x×1=(n-3x)×1,
由n=10x,即还原剂为3x,氧化剂为7x,所以氧化剂和还原剂的物质的量之比为7:3,故答案为:7:3.

已知氯气和氢氧化钠的反应条件不同,产物也不同,在实验室里可用如图所示装置制取氯酸钠次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15mL30%NaOH溶液,并置于热水浴中;
③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。 请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钠和次氯酸钠的条件,指出二者的差异:______________________。
(3)本实验中制取次氯酸钠的离子方程式是__________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的 |
| 随后溶液逐渐变为无色 |
|
| 然后溶液从无色逐渐变为_______色 |
|
已知氯气和氢氧化钠的反应条件不同,产物也不同,在实验室里可用如图所示装置制取氯酸钠次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15mL30%NaOH溶液,并置于热水浴中;
③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。 请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钠和次氯酸钠的条件,指出二者的差异:______________________。
(3)本实验中制取次氯酸钠的离子方程式是__________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的 |
| 随后溶液逐渐变为无色 |
|
| 然后溶液从无色逐渐变为_______色 |
|
(10分)在实验室里可用如图所示装置制取氯酸钾和探究氯水的性质。图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置。请填写下列空白: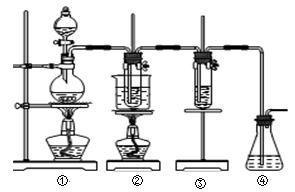
⑴制取氯气时,先在烧瓶里加入一定量的二氧化锰,再通过__________ ___(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_____________(填写下列编号字母)的净化装置。
___(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_____________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因有:①_______________________________________________,
②__________________________________________________________________________。
⑶反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷实验中可观察到③的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为_______色 | ______________________________________ |
已知氯气和氢氧化钠的反应条件不同,产物也不同,在实验室里可用如图所示装置制取氯酸钠次氯酸钠和探究氯水的性质。
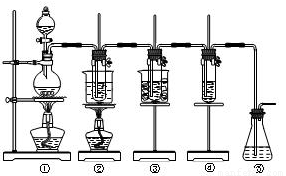
图中:①为氯气发生装置;②的试管里盛有15mL30%NaOH溶液,并置于热水浴中;
③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。 请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钠和次氯酸钠的条件,指出二者的差异:______________________。
(3)本实验中制取次氯酸钠的离子方程式是__________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为_______色 |
|
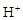 使石蕊变色
使石蕊变色