题目内容
下列各表述与示意图图中一致的是 ( )
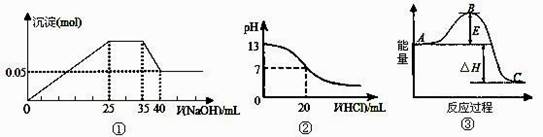
A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶3∶2
B.图①中使用的NaOH的浓度为2 mol/L
C.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
D.图③中曲线表示3N2(g)+N2(g) 2NH3(g)反应过程的能量变化,若使用催化剂,B点会升高
2NH3(g)反应过程的能量变化,若使用催化剂,B点会升高
【答案】
C
【解析】图①中溶解氢氧化铝消耗的氢氧化钠是5ml,则生成氢氧化铝消耗的氢氧化钠是15ml,所以和镁离子反应的氢氧化钠是10ml,而与NH4+反应的氢氧化钠是10ml,所以n(Mg2+)∶n(Al3+):n( NH4+)=1∶2∶1,选项A不正确;图①中氢氧化镁是0.05mol,则消耗氢氧化钠是0.1mol,所以氢氧化钠的浓度是0.1mol÷0.01L=10mol/L,选项B不正确;催化剂能降低反应的活化能,即可反应速率,所以选项D不正确,因此正确的答案选C。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目




