题目内容
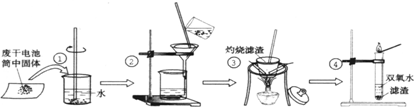
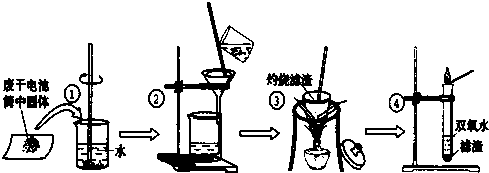
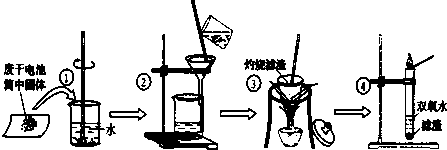
某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______、______;
(2)操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣可能为MnO2,试管中发生反应的化学方程式:______;
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为:______.
(4)已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
1.[猜想I]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]:______(填“猜想I成立”或“猜想I不成立”).
2.[猜想II]:主要成分为氯化锌;
[验证(操作)过程]:______;
[实验现象]:______;
[判断猜想]:猜想Ⅱ成立;由上述实验得出结论:滤液中的主、次成分:______.
解:(1)操作③灼烧滤渣在坩埚中加热,坩埚放在泥三角上加热;故答案为:坩埚、泥三角、三脚架、坩埚钳;
故答案为:坩埚、泥三角、三脚架、坩埚钳;
(2)操作④的试管中含有过氧化氢加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣可能为MnO2,催化过氧化氢分解生成水和氧气,试管中发生反应的化学方程式:2H2O2 2H2O+O2↑;
2H2O+O2↑;
故答案为:2H2O2 2H2O+O2↑;
2H2O+O2↑;
(3)使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,二氧化碳可由黑色的碳单质灼烧制得,二氧化硫可由淡黄色的硫单质灼烧制得,所以该黑色物质是碳单质;故答案为:碳;
(4)铵根离子的检验:铵根离子能和强碱在加热条件下反应生成氨气,氨气具有刺激性气味,未闻到明显的氨的刺激性气味,就说明有铵根离子不是大量存在.
氯化锌的测量则是利用题干中的信息:氯化锌溶液中逐滴滴入稀氨水,先生成Zn(OH)2白色沉淀,然后溶解生成可溶于水的Zn(NH3)4Cl2.从而依据反应的现象待测液中加入氨水,先有白色沉淀、后溶解,则证明氯化锌的存在;滤液中的主、次成分主要为氯化锌,其中含少量的氯化铵;
故答案为:猜想I不成立;取少量滤液逐滴滴入稀氨水;先有白色沉淀、滴入过量稀氨水后白色沉淀溶解;主要为氯化锌,其中含少量的氯化铵;
分析:(1)操作③灼烧滤渣在坩埚中加热,坩埚放在泥三角上加热;
(2)依据二氧化锰催化作用,可以促使过氧化氢分解生成水和氧气;
(3)黑色的二氧化锰,依据生成二氧化碳气体证明黑色固体中含有碳;
(4)依据铵根离子的检验方法以及题干中的氯化锌与氨水的反应分析解答即可;
点评:本题考查了实验基本操作物质组成的分析判断,实验设计验证,物质性质的熟练掌握,实验设计的方法,实验验证的应用,是解题关键,题目难度中等.
故答案为:坩埚、泥三角、三脚架、坩埚钳;
(2)操作④的试管中含有过氧化氢加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣可能为MnO2,催化过氧化氢分解生成水和氧气,试管中发生反应的化学方程式:2H2O2
 2H2O+O2↑;
2H2O+O2↑;故答案为:2H2O2
 2H2O+O2↑;
2H2O+O2↑;(3)使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,二氧化碳可由黑色的碳单质灼烧制得,二氧化硫可由淡黄色的硫单质灼烧制得,所以该黑色物质是碳单质;故答案为:碳;
(4)铵根离子的检验:铵根离子能和强碱在加热条件下反应生成氨气,氨气具有刺激性气味,未闻到明显的氨的刺激性气味,就说明有铵根离子不是大量存在.
氯化锌的测量则是利用题干中的信息:氯化锌溶液中逐滴滴入稀氨水,先生成Zn(OH)2白色沉淀,然后溶解生成可溶于水的Zn(NH3)4Cl2.从而依据反应的现象待测液中加入氨水,先有白色沉淀、后溶解,则证明氯化锌的存在;滤液中的主、次成分主要为氯化锌,其中含少量的氯化铵;
故答案为:猜想I不成立;取少量滤液逐滴滴入稀氨水;先有白色沉淀、滴入过量稀氨水后白色沉淀溶解;主要为氯化锌,其中含少量的氯化铵;
分析:(1)操作③灼烧滤渣在坩埚中加热,坩埚放在泥三角上加热;
(2)依据二氧化锰催化作用,可以促使过氧化氢分解生成水和氧气;
(3)黑色的二氧化锰,依据生成二氧化碳气体证明黑色固体中含有碳;
(4)依据铵根离子的检验方法以及题干中的氯化锌与氨水的反应分析解答即可;
点评:本题考查了实验基本操作物质组成的分析判断,实验设计验证,物质性质的熟练掌握,实验设计的方法,实验验证的应用,是解题关键,题目难度中等.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目