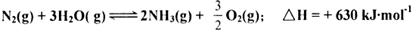题目内容
(13分)(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。
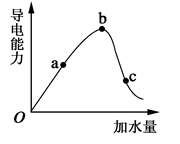
(2)“O”点为什么不导电 。
(3)a、b、c三点的氢离子浓度由小到大的顺序为 。
(4)a、b、c三点中,醋酸的电离程度最大的一点是 。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择 。
A.加NaCl溶液 B.加热
C.加固体KOH D.加Zn粒
E.加固体CH3COONa F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数 B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子数

(2)“O”点为什么不导电 。
(3)a、b、c三点的氢离子浓度由小到大的顺序为 。
(4)a、b、c三点中,醋酸的电离程度最大的一点是 。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择 。
A.加NaCl溶液 B.加热
C.加固体KOH D.加Zn粒
E.加固体CH3COONa F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数 B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子数
(1)0.1 mol/L 1 10-13 mol/L (2)因为冰醋酸未电离,无自由移动的离子
(3)c<a<b (4)c (5)B、C、D、E (6)A、C
(3)c<a<b (4)c (5)B、C、D、E (6)A、C
试题分析:(1)0.05mol/L硫酸溶液中c(H+)=0.1 mol/L,pH值为1,水电离的c(H+)为10-13 mol/L。
(2)在O点醋酸没有电离,只有醋酸分子,无自由移动的离子,所以不能导电。
(3)氢离子浓度越大,导电能力越强,所以根据图像可知氢离子浓度的大小顺序为b>a>c。
(4)醋酸是弱酸,存在电离平衡,稀释促进电离,所以c点醋酸的电离程度最大。
(5)根据CH3COOH
 CH3COO-+H+,加NaCl溶液,平衡不移动c(CH3COO-)不变,加热平衡正向移动,c(CH3COO-)增大,加固体KOH,平衡正向移动,c(CH3COO-)增大,加Zn粒,平衡正向移动,c(CH3COO-)增大,加固体CH3COONa,平衡逆向移动,但c(CH3COO-)增大,加水平衡正向移动,但c(CH3COO-)减小。所以能使c(CH3COO-)增大的措施是BCDE。
CH3COO-+H+,加NaCl溶液,平衡不移动c(CH3COO-)不变,加热平衡正向移动,c(CH3COO-)增大,加固体KOH,平衡正向移动,c(CH3COO-)增大,加Zn粒,平衡正向移动,c(CH3COO-)增大,加固体CH3COONa,平衡逆向移动,但c(CH3COO-)增大,加水平衡正向移动,但c(CH3COO-)减小。所以能使c(CH3COO-)增大的措施是BCDE。(6)根据CH3COOH
 CH3COO-+H+,稀释过程中平衡正向移动,H+个数增加,c(H+)减小,c(CH3COO-)减小,CH3COOH分子数减小,根据K=
CH3COO-+H+,稀释过程中平衡正向移动,H+个数增加,c(H+)减小,c(CH3COO-)减小,CH3COOH分子数减小,根据K= ,c(CH3COO-)减小,所以
,c(CH3COO-)减小,所以 增大。因此选AC。
增大。因此选AC。点评:本题综合性较强,难度较大,主要要运用好平衡常数。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
 HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
 ?2X Y2(g) ΔH<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是
?2X Y2(g) ΔH<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是
 XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法: PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是 C(s)+4D(g)+Q,右图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度 ②升高反应温度 ③缩小反应容器的体积(加压) ④加入催化剂( )
C(s)+4D(g)+Q,右图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度 ②升高反应温度 ③缩小反应容器的体积(加压) ④加入催化剂( )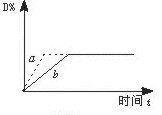
 。若加入少量醋酸钠固体,则CH3COOH
。若加入少量醋酸钠固体,则CH3COOH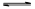 CH3COO-+H+向左移动,α减小,Ka变小
CH3COO-+H+向左移动,α减小,Ka变小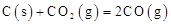 不能自发进行,则该反应的
不能自发进行,则该反应的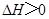
 NH3·H2O+H+,若用KW表示的离子积,
NH3·H2O+H+,若用KW表示的离子积,