ЬтФПФкШн
ЁОЬтФПЁПРћгУКЌЬМЛЏКЯЮяКЯГЩаТШМСЯЪЧЗЂеЙЕЭЬМОМУЕФживЊЗНЗЈЃЌвбжЊЃКCO(g) + 2H2(g)![]() CH3OH(g)ЪЧКЯГЩМзДМЃЈCH3OHЃЉЕФЗДгІЃЌИУЗДгІЙ§ГЬЕФФмСПБфЛЏШчЭМЫљЪОЃЌЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
CH3OH(g)ЪЧКЯГЩМзДМЃЈCH3OHЃЉЕФЗДгІЃЌИУЗДгІЙ§ГЬЕФФмСПБфЛЏШчЭМЫљЪОЃЌЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
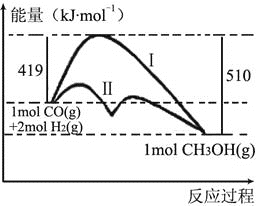
A. COЃЈgЃЉгыH2ЃЈgЃЉЗДгІЩњГЩ1mol CH3OHЃЈgЃЉЪЭЗХГі91kJЕФФмСП
B. гУЬМжЦБИдСЯЦјCOЁЂH2ЕФЗДгІЪєгкЗХШШЗДгІ
C. ЗДгІЮязмМќФмИпгкЩњГЩЮяЕФзмМќФм
D. ШєИУЗДгІЩњГЩвКЬЌCH3OHЃЌдђЗХГіЕФФмСПИќЩй
ЁОД№АИЁПA
ЁОНтЮіЁПAЃЎгЩЭМПЩжЊЃЌЩњГЩ1 mol CH3OHЃЈgЃЉЗХГі510kJЃ419kJЃН91kJЕФФмСПЃЌAе§ШЗЃЛBЃЎЬМгыЫЎеєЦјЗДгІжЦБИCOЁЂH2ЕФЗДгІЪєгкЮќШШЗДгІЃЌBДэЮѓЃЛC.ЗДгІЪЧЗХШШЗДгІЃЌдђЗДгІЮязмМќФмЕЭгкЩњГЩЮяЕФзмМќФмЃЌCДэЮѓЃЛDЃЎЭЌжжЮяжЪЕФЦјЬЌБШвКЬЌФмСПИпЃЌдђШчЙћЩњГЩвКЬЌCH3OHЃЌдђЗХГіЕФФмСПИќЖрЃЌDДэЮѓЃЛД№АИбЁAЁЃ

ЁОЬтФПЁПвбжЊМзКЭввЕФФГаЉаджЪШчБэЫљЪОЃК
ЮяжЪ | ШлЕуЃЈЁцЃЉ | ЗаЕуЃЈЁцЃЉ | УмЖШЃЈg/mLЃЉ | ЫЎжаЕФШмНтад |
Мз | -98 | 37.5 | 0.93 | ПЩШм |
вв | -48 | 95 | 0.90 | ПЩШм |
ЯжгаМзКЭввЕФЛьКЯЮяЃЌНјааЗжРыЪБЃЌПЩВЩгУЕФЗНЗЈЪЧЃЈ ЃЉ
A.Й§ТЫB.еєЗЂC.еєСѓD.нЭШЁ
ЁОЬтФПЁПГЃЮТЯТЃЌЯТСаИїзщЮяжЪжаЃЌYМШФмгыXЗДгІгжФмгыZЗДгІЕФЪЧ
X | Y | Z | |
Ђй | NaOHШмвК | NH4HCO3 | ЯЁСђЫс |
Ђк | KOHШмвК | SO2 | ХЈСђЫс |
Ђл | O2 | N2 | H2 |
Ђм | FeCl3ШмвК | Cu | ХЈЯѕЫс |
A.ЂйЂлB.ЂйЂмC.ЂкЂлD.ЂкЂм