题目内容
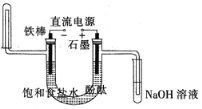
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)焙烧过程中主要反应的化学方程式为__________。
(2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是_____________,若不通入氧气,其后果是___________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为__________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为__________;沉积锌后的电解液可返回________工序继续使用。
【答案】2ZnS+3O2![]() 2ZnO+2SO2 PbSO4 调节溶液的pH 无法除去杂质Fe2+ Cd2++Zn===Cd+Zn2+ Zn2++2e-===Zn 溶浸
2ZnO+2SO2 PbSO4 调节溶液的pH 无法除去杂质Fe2+ Cd2++Zn===Cd+Zn2+ Zn2++2e-===Zn 溶浸
【解析】
焙烧时,硫元素转化为二氧化硫,然后用稀硫酸溶浸,生成硫酸锌,硫酸亚铁和硫酸镉,二氧化硅与稀硫酸不反应转化为滤渣,因硫酸铅不溶于水,故滤渣1中还含有硫酸铅。由于沉淀亚铁离子的pH较大,需要将其氧化为铁离子,通过控制pH得到氢氧化铁沉淀;滤液中加入锌粉置换出镉,最后将滤液电解得到金属锌,据以上分析进行解答。
(1)闪锌矿的主要成分ZnS在高温下易被氧气氧化,得到产物ZnO和SO2;
故答案为:2ZnS+3O2![]() 2ZnO+2SO2;
2ZnO+2SO2;
(2)PbS在高温下与氧气反应生成PbO与SO2,PbO与酸反应生成难溶于酸的PbSO4,故滤渣1中还有PbSO4;由金属离子形成氢氧化物沉淀的pH可知,需要将Fe2+转化为Fe3+,生成Fe(OH)3沉淀除去,故加入ZnO与溶液中的H+反应,调节溶液pH来沉淀Fe3+;若不通入氧气,则无法将Fe2+转化为Fe3+,完全沉淀Fe2+时Zn2+也会被沉淀。
故答案是:PbSO4;调节溶液的pH;无法除去杂质Fe2+;
(3)Zn将Cd2+还原为Cd单质:Cd2++Zn===Cd+Zn2+;
故答案是:Cd2++Zn===Cd+Zn2+;
(4)电解硫酸锌溶液,阴极发生反应的是溶液中的Zn2+,反应式为:Zn2++2e-=Zn;阳极发生反应的物质为水电离出的OH-,极反应:2H2O-4e-=O2+4H+,反应后电解液中剩余离子为氢离子和硫酸根,故可循环参与过程中的溶浸。
故答案是:Zn2++2e-===Zn;溶浸。