题目内容
实验室用下列方法测定某水样中O2的含量。

(1)用如上图所示装置,c是长橡胶管。使水中溶解的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为______________________。
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的________________。
②用注射器抽取20.00mL某水样从A处注入锥形瓶。
③再分别从A处注入含m mol NaOH的溶液及过量的MnSO4溶液。
④完成上述操作后,下面应进行的操作是___________。
A.微热锥形瓶 B.夹紧止水夹a、b C.充分振荡锥形瓶 D.继续通入N2
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
⑤接着④操作后,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重复第④步操作。
(3)用Na2S2O3标准溶液滴定(2)中生成的I2,反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。
⑧用 0.005mol·L-1 Na2S2O3滴定至终点,终点现象_______________________。
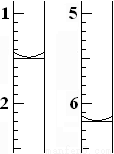
(4)滴定过程中,滴定前后滴定管中的液面读数如图所示。
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1)_______________。
练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目


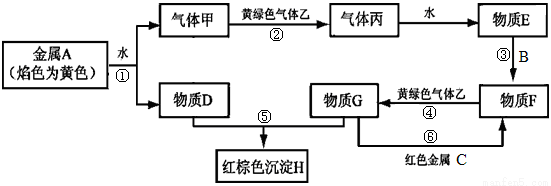
 1)写出下列物质的化学式: B____________,气体丙_______________。
1)写出下列物质的化学式: B____________,气体丙_______________。 Na2SiO3+CO2↑ B.CO+H2O
Na2SiO3+CO2↑ B.CO+H2O CO2+H2
CO2+H2 Na2CO3+H2O D.CO+2H2
Na2CO3+H2O D.CO+2H2 CH3OH
CH3OH 乙酸乙酯,其合成路线如下图所示。回答下列问题:
乙酸乙酯,其合成路线如下图所示。回答下列问题:

 B.
B.  C.
C.  D.
D. 

 2NH3(g)在恒温情况下,反应速率与压强的关系
2NH3(g)在恒温情况下,反应速率与压强的关系