题目内容
在其他条件不变时,设某物质在10℃时反应速率为3mol·(L·s)-1,每升高10℃,反应速率是原来的3倍,那么50℃,反应速率是( )
| A.9mol·(L·s)-1 | B.27mol·(L·s)-1 |
| C.81mol·(L·s)-1 | D.243mol·(L·s)-1 |
D
解析

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
Fenton试剂常用于氧化降解有机污染物X。在一定条件下.反应初始时c(X)=2.0×10-3 mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是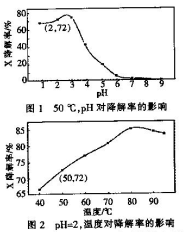
| A.50oC,PH在3~6之间,X降解率随PH增大而减小 |
| B.PH=2,温度在40~80 oC,X降解率温度升高而增大 |
| C.无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80 oC |
| D.PH=2、温度为50oC,10min内v(X)=1.44x10-4 mol·L-1min-1 |
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
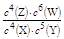
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
化学平衡常数(K)、电离常数(Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是( )
| A.化学平衡常数的大小与温度、浓度、压强、催化剂有关 |
| B.CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与Kb(NH3·H2O)近似相等 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明相同浓度时,氢氰酸的酸性比醋酸强 |
一定条件下,可逆反应2A(g) B(g)+3C(g),下列四项中处于平衡状态的是( )
B(g)+3C(g),下列四项中处于平衡状态的是( )
| | 正反应速率 | 逆反应速率 |
| A | v(A)=2mol/(L·min) | v(B)=2mol/(L·min) |
| B | v(A)=2mol/(L·min) | v(C)=2mol/(L·min) |
| C | v(A)=1mol/(L·min) | v(B)=2mol/(L·min) |
| D | v(A)=1mol/(L·min) | v(C)=1.5mol/(L·min) |
其他条件不变时,能使反应速率加快的是( )
| A.对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,增大体系的压强 |
B.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入Ar 2NH3(g),容器体积固定不变时,充入Ar |
C.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入N2 2NH3(g),容器体积固定不变时,充入N2 |
D.对于N2(g)+3H2(g) 2NH3(g),容器气体压强不变时,充入Ar 2NH3(g),容器气体压强不变时,充入Ar |
一定条件下存在反应:CO(g)+H2O(g)  CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1 |
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
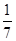
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
 2C(g)达到平衡状态标志的是( )。
2C(g)达到平衡状态标志的是( )。