题目内容
用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A. 配制标准溶液的固体NaOH中混有杂质KOH
B. 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C. 滴定终点读数时,俯视滴定管的刻度,其他操作正确
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
四种易溶于水的强电解质A、B、C、D由以下7种离子组成(电解质中阴离子各不相同)。
阴离子 | Na+ Ba2+ NH4+ |
阳离子 | CH3COO- Cl- OH- SO42- |
已知:①A、C溶液显碱性,A、B的溶液中水的电离程度相同;②C和D的溶液混合反应的现象只是有白色沉淀生成,B和C的溶液混合反应的现象只是有刺激性气味的气体生成,A和D的溶液混合无明显现象。
(1)A是__________,B是_____________。
(2)写出C与D的溶液反应的离子方程式_______________________。
(3)25℃时,0.1mol/LB溶液的pH=a,则B溶液中c(H+)—c(NH3·H2O)=_______________(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合反应后溶液中各种离子浓度由大到小的顺序是______________________。
(5)向用盐酸中和后的C溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br—)/c(Cl—) =_________。(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)


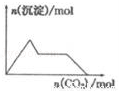
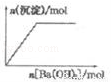
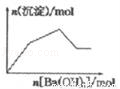
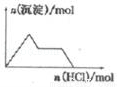
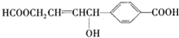 的性质叙述正确的是
的性质叙述正确的是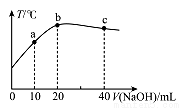
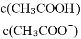 逐渐增大
逐渐增大