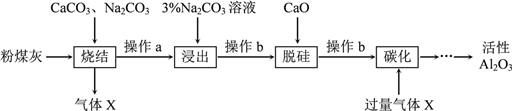
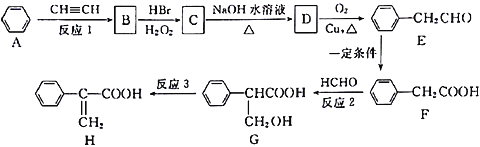
题目内容
【题目】将一块镁铝合金溶于盐酸后,加入过量氢氧化钠溶液,过滤后灼烧沉淀物,所得白色粉末的质量等于原合金的质量,则该合金中镁铝的质量比是( )
A.3:2B.2:3C.1:1D.2:1
【答案】A
【解析】
镁铝合金粉末溶于足量盐酸中,得到含有氯化镁、氯化铝和盐酸的混合液,向混合液中加入过量NaOH 溶液,氢氧化铝为两性氢氧化物,能溶于氢氧化钠溶液,则所得的沉淀为氢氧化镁,沉淀经洗涤、干燥、灼烧,氢氧化镁分解生成氧化镁和水,则得到白色粉末为MgO,MgOg质量等于Mg、Al合金的质量,由镁原子个数守恒可知,氧化镁中氧元素的质量等于合金中铝的质量,则合金中Mg、Al的质量比为24:16=3:2,故选A。

 考前必练系列答案
考前必练系列答案【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
(定性实验)检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_________和__________;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是________________;
(定量试验)测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.
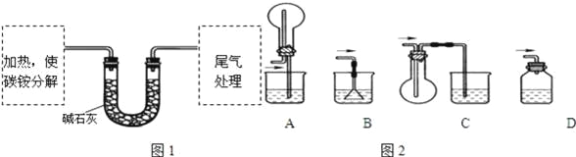
(3)碳铵固体应放在________中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2中的___________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_________g.