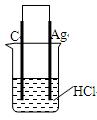
题目内容
用石墨电极电解100 mL硫酸铜和硫酸的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),原混合溶液中Cu2+的物质的量浓度(mol·L-1)为
| A.4 | B.3 | C.2 | D.1 |
D
电解硫酸铜和硫酸的混合溶液,阳极电极反应式为:4OH——4e—=O2+2H2O;
阴极电极反应式为:2Cu2++4e—=2Cu,当Cu2+全部放电完毕后,溶液中的H+继续放电,电极反应式为:2 H++2 e—=H2;根据氧化还原反应过程中得失电子数相等地,可求得原混合溶液中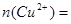 0.1 mol,即可得原混合溶液中Cu2+的物质的量浓度1 mol·L-1
0.1 mol,即可得原混合溶液中Cu2+的物质的量浓度1 mol·L-1
阴极电极反应式为:2Cu2++4e—=2Cu,当Cu2+全部放电完毕后,溶液中的H+继续放电,电极反应式为:2 H++2 e—=H2;根据氧化还原反应过程中得失电子数相等地,可求得原混合溶液中
 0.1 mol,即可得原混合溶液中Cu2+的物质的量浓度1 mol·L-1
0.1 mol,即可得原混合溶液中Cu2+的物质的量浓度1 mol·L-1
练习册系列答案
相关题目

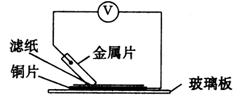
 则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为:
则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为: 被腐蚀
被腐蚀 ______ _,负极:__________________________________________________________。
______ _,负极:__________________________________________________________。