题目内容
在进行钠和水的反应实验中,有如下操作和实验现象,请根据钠的性质解释说明。
(1)刚用小刀切开的金属钠断面呈_______色,在空气中放置几分钟后发生的变化为______________。
(2)切下来的金属钠块要用滤纸擦净后方可放入水中实验,这是因为________________。
(3)金属钠块必须用_______夹取,而不能用手拿取,理由是________________________。
(4)金属钠块投入水中后,钠很快熔成一个闪亮的小球并浮于水面上,这是因为______ _。
(5)钠小球在水面上迅速游动,这是因为_____________________________________,反应容器的上方弥漫着“白色物”,它的主要成分是_ ________________。
(6)如果水中在未加钠之前已滴入酚酞试溶,反应后溶液由无色变为_________________色,理由是____________________________。
(1)银白 变暗 这是因为钠与氧气反应,在钠的表面生成了一薄层氧化物所致
(2)用滤纸吸干钠块表面煤油,防止钠与水反应放热,引起煤油燃烧
(3)镊子 手指表面有水份,能跟钠块反应生成强碱NaOH腐蚀皮肤
(4)钠的密度比水小,与水反应,放热,使钠熔化形成银白色小球
(5)钠与水反应放出氢气,推动钠球在水面上运动 钠与水反应放热使与钠球接触的水蒸发,在容器上方凝聚而形成白雾。
(6)钠与水反应生成NaOH,使酚酞变红

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案(13分)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的摩尔质量为 ___________ |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为________________ |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团_____________、_____________ |
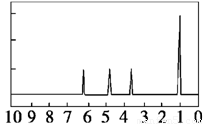
| (4)A的核磁共振氢谱如下图: |
(4)综上所述,A的结构简式为
__________________________
|
(5)试举两种常见有机物,它们与A无论以何种比例混合,只要混合物的总质量一定,则完全燃烧后混合物所消耗的O2以及燃烧后生成的H2O和CO2的量均为定值_________________
(6)A在一定条件下可以生成C6H8O4的环状化合物,写出其发生反应的化学方程式
_________________________________________________________________________________
(13分)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的摩尔质量为 ___________ |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为________________ |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团_____________、_____________ |
(4)A的核磁共振氢谱如下图: | (4)综上所述,A的结构简式为 __________________________ |
(6)A在一定条件下可以生成C6H8O4的环状化合物,写出其发生反应的化学方程式
_________________________________________________________________________________
(13分)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
|
实 验 步 骤 |
解释或实验结论 |
|
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的摩尔质量为 ___________ |
|
(2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为________________ |
|
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团_____________、_____________ |
|
(4)A的核磁共振氢谱如下图:
|
(4)综上所述,A的结构简式为
__________________________
|
(5)试举两种常见有机物,它们与A无论以何种比例混合,只要混合物的总质量一定,则完全燃烧后混合物所消耗的O2以及燃烧后生成的H2O和CO2的量均为定值_________________
(6)A在一定条件下可以生成C6H8O4的环状化合物,写出其发生反应的化学方程式
_________________________________________________________________________________
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).

请按要求填空:
(1)利用B装置可制取的气体有____________(写出两种即可).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实
验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由________________
________________________________.
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛放的试剂、实验现象及结论)____________
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为______________________________________
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是________________.
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的氧气,直到试管全部充满水,则所得溶液中溶质的物质的量浓度是________(气体按标准状况计算).