题目内容
(12分)前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2。
(1)X的元素符号为_______,Z元素位于周期表第_______周期第________族。
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是________(写分子式)。
(3)Z的最高价氧化物的水化物的化学式为________________。
(4)12.4 g单质Y4与0.3 mol O2在一定条件下恰好完全反应生成0.1 mol化合物C,一个C分子中所含有的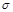 键数目为 。
键数目为 。
(5)含W元素的最高化合价的含氧酸根离子是___________,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与Fe2+反应的离子方程式:
______________________________________________________________________。
(1)X的元素符号为_______,Z元素位于周期表第_______周期第________族。
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是________(写分子式)。
(3)Z的最高价氧化物的水化物的化学式为________________。
(4)12.4 g单质Y4与0.3 mol O2在一定条件下恰好完全反应生成0.1 mol化合物C,一个C分子中所含有的
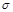 键数目为 。
键数目为 。(5)含W元素的最高化合价的含氧酸根离子是___________,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与Fe2+反应的离子方程式:
______________________________________________________________________。
(1) H 三 ⅦA (各1分) (2) PH3(2分)(3) HClO4(1分)
(4) 12(2分) (5) MnO4-(1分) MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O(3分)
(4) 12(2分) (5) MnO4-(1分) MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O(3分)
Y 原子的M层p轨道有3个未成对电子,则Y是P。Z与Y同周期,且在该周期中电负性最大,因为非金属性越强,电负性越大,所以Z是Cl。W原子的L层电子数与最外层电子数之比为4∶1,所以最外层电子数是2。又因为d轨道中的电子数与最外层电子数之比为5∶2,所以该元素的原子序数是锰。X、Y、Z、W核电荷数依次增加,核电荷数之和为58,所以X是氢。
(1)氯元素是第三周期第ⅦA。
(2)非金属越强,相应阴离子的还原性就越弱,氯的非金属性强于P的,所以PH3的还原性强于氯化氢的。
(3)氯的最高价是+7价,所以最高价氧化物的水化物的化学式为HClO4。
(4)12.4 g白磷的物质的量是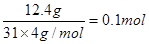 ,所以根据原子守恒可知,化合物C的化学式为P4O6,即该化合物的结构式就是在白磷中每2个磷原子中间插入1个氧原子。因为白磷是正四面体型结构,所以一个C分子中所含有的
,所以根据原子守恒可知,化合物C的化学式为P4O6,即该化合物的结构式就是在白磷中每2个磷原子中间插入1个氧原子。因为白磷是正四面体型结构,所以一个C分子中所含有的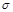 键数目为12。
键数目为12。
(5)锰的最高价是+7价,最高化合价的含氧酸根离子是MnO4-。MnO4-具有强氧化性,能把亚铁离子氧化生成铁离子,MnO4-被还原生成Mn2+,方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。
(1)氯元素是第三周期第ⅦA。
(2)非金属越强,相应阴离子的还原性就越弱,氯的非金属性强于P的,所以PH3的还原性强于氯化氢的。
(3)氯的最高价是+7价,所以最高价氧化物的水化物的化学式为HClO4。
(4)12.4 g白磷的物质的量是
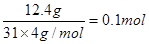 ,所以根据原子守恒可知,化合物C的化学式为P4O6,即该化合物的结构式就是在白磷中每2个磷原子中间插入1个氧原子。因为白磷是正四面体型结构,所以一个C分子中所含有的
,所以根据原子守恒可知,化合物C的化学式为P4O6,即该化合物的结构式就是在白磷中每2个磷原子中间插入1个氧原子。因为白磷是正四面体型结构,所以一个C分子中所含有的 键数目为12。
键数目为12。(5)锰的最高价是+7价,最高化合价的含氧酸根离子是MnO4-。MnO4-具有强氧化性,能把亚铁离子氧化生成铁离子,MnO4-被还原生成Mn2+,方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
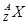 ,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
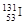 、
、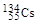 、
、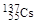 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )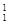 H、
H、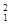 H、
H、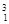 H、
H、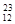 Mg、
Mg、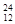 Mg和
Mg和 Cu中共有___ ___种元素,__ ____种原子。
Cu中共有___ ___种元素,__ ____种原子。