题目内容
【题目】已知8NH3+3Cl26NH4Cl+N2,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
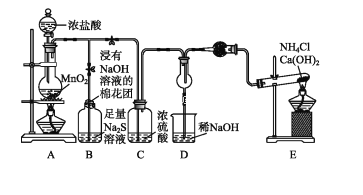
(1)写出E中反应的化学方程式_____。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式______________。
(3)D中干燥管中出现的现象是_______________。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂______。
(5)通入D装置的两根导管左边较短、右边较长,目的是________________________
【答案】2 NH4Cl+Ca(OH)2![]() 2NH3↑+2H2O+CaCl2 S2-+Cl2==S↓+2Cl- 产生大量白烟 饱和食盐水 使密度大的氯气和密度小的氨气均匀混合
2NH3↑+2H2O+CaCl2 S2-+Cl2==S↓+2Cl- 产生大量白烟 饱和食盐水 使密度大的氯气和密度小的氨气均匀混合
【解析】
装置A制取氯气,B装置为验证非金属元素氯的氧化性强于硫,B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性;浓盐酸易挥发,经过浓硫酸干燥的氯气中仍混有少量氯化氢气体,因此需要在C之前加装洗气装置,为该实验装置设计缺陷;盛放氢氧化钠的烧杯吸收尾气,装置E生成氨气,装置D氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,会冒白烟,可以验证非金属元素氯的氧化性强于氮,据此分析解答。
(1)装置E中氯化铵和氢氧化钙固体加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2 ![]() 2NH3↑+2H2O+CaCl2;故答案为:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;故答案为:2NH4Cl+Ca(OH)2 ![]() 2NH3↑+2H2O+CaCl2;
2NH3↑+2H2O+CaCl2;
(2)反应制备的氯气通入B之后,B中出现黄色浑浊现象,说明氯气把硫化钠溶液中的硫离子氧化为S单质,离子方程式为Cl2+S2-=S↓+2Cl-,故答案为:Cl2+S2-=S↓+2Cl-;
(3)E装置是制备氨气,氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,因此D中干燥管中可以看到大量白烟,故答案为:产生大量白烟;
(4)浓盐酸易挥发,所以生成的氯气中含有氯化氢气体,氯化氢也能直接和氨气结合冒白烟,所以需要在C之前连接盛有饱和食盐水的装置以除去氯化氢气体,故答案为:饱和食盐水;
(5)氯气的密度大于空气,氨气的密度小于空气,为了能够使两种气体充分接触反应,通入D装置的两根导管左边较短、右边较长,故答案为:使密度大的氯气和密度小的氨气均匀混合。

【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
【题目】已知2A2(g)+B2(g)![]() 2C3(g)△H=-akJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后
2C3(g)△H=-akJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后![]() 的浓度为xmol·L-1,放出热量bkJ。请回答下列问题:
的浓度为xmol·L-1,放出热量bkJ。请回答下列问题:
(1) a__________(填“>”、“=”或“ <”) b。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中T1__________(填“ >”、“ < ”或“ =”) T2。
|
|
|
|
|
|
|
|
若在原来的容器中,只加入2molC3,500℃时充分反应达到平衡后,吸收热量ckJ,则C3的浓度__________(填“>”、“=” 或“ <”) xmol·L-1,a、b、c之间满足何种关系?__________(用代数式表示)。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是__________(填字母)。
A.4molA2和2molB2 B.4molA2、2molB2和2molC3
C.4molA2和4molB2 D.6molA2和4molB2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________(填字母)。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达到平衡后,放出热量dkJ,则d__________(填“>”、“=” 或“ <”) b,理由是__________。
(6)在一定温度下,在一个容积不变的容器中通入2molA2和1molB2及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为4molA2和2molB2,则平衡时A2的转化率__________(填span>“不变”、“变大”、“变小”或“不能确定”)。
